
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向NaAlO2溶液中通入足量CO2气体:2AlO2--+CO2+3H2O=2Al(OH)3↓+CO32--
B.向含nmolNH4Al(SO4)2的溶液中,逐滴加入含nmolNaOH的溶液:Al3++3OH--=Al(OH)3↓
C.向溴水中通入SO2气体:SO2+Br2+2H2O=2H++SO42--+2HBr
D.含2nmolNaOH的溶液和含nmolCa(HCO3)2的溶液混合OH--+Ca2++HCO3--=CaCO3↓+H2O
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
美国天文学家在亚利桑那州一天文观测台探测到了距银河系中心2.6亿光年处一巨大气云中的特殊电磁波这种电磁波表明那里可能有乙醇醛糖分子存在。下列有关乙醇醛糖(HOCH2CHO)的说法不正 确的是
确的是
A.HOCH2CHO能发生取代反应、加 成反应、氧化反应
成反应、氧化反应 和还原反应
和还原反应
B.乙醇醛糖属于醛和糖的混合物
C.HOCH2CHO与乙酸、甲酸甲酯互为同分异构体
D.乙醇醛糖与葡萄糖具有相似的化学性质
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
用N0表示阿伏加德罗 常数的值,下列说法中不正确的是
常数的值,下列说法中不正确的是
A.将氯气通入足量氢氧化钠溶液中,当消耗4nmolNaOH时,反应中转移的电子为4nN0
B.4.4g由N2O和CO2组成的混合气体含0.3N0个原子
C.23.4gNaCl晶体中含0.1N0个右图所示的结构单元
D.7.8gNa2O2与足量潮湿的CO2反应,转移的电子数为0.1N0
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
X、Y、Z三种元素都是短周期的主族元素。X是同周期主族元素中原子半径最大的元素;Y元素的原子的最外层电子数是其所在周期数的二倍;Z元素原子的最外层电子数是其所在周期数的三倍。下列有关叙述中正确的是
A. 用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大
B. 由X、Y、Z形成的化合物的分子式一定为X2YZ3
C. 由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性。
D. X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色会逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉在水的催化下与溴发生反应
C.产生极少量的气泡是由于镁粉与水反应得到的
D.镁粉只与溴水中的酸反应
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:选择题
用惰性电极电解200mL1.0 mol·L-1的硫酸铜溶液,当两极上产生气体物质的量相同时,停止电解,此时要使溶液恢复到电解前的状态,需要加入的物质及物质的量是
A.0.2molCu(OH)2 B.0.2molCuO
C.0.2molCuSO4+0.2molH2O D.0.1molCu2(OH)2CO3
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:实验题
现有如下药品和装置:mg锌片、铁片、稀硫酸、水,设计一个实验,测定锌的相对原子质量(实验是在通常状况下进行的)。请完成下列实验:
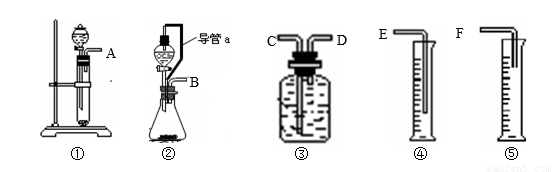
(1)写出该反应的化学方程式 。
(2)所选用装置的连接顺序为(填接口字母) 。
(3)取Wg纯铁片与稀硫酸反应测得生成气体V1mL,该步骤的目的是 。
(4)实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒④,使其中液面与广口瓶中液面相平
C.上下移动量筒⑤,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(5)mg锌片与稀硫酸反应测得生成气体V2mL,则Zn的相对原子质量的数学表达式为 (用上述字母表示)。
(6)假设锌片中含不与酸反应的杂质,实验测得锌的相对原子质量可能比真实值(填“偏大”、“偏小”或“不变”,下同) ;实验结束时,仰视量筒读数,测得值 。
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:填空题
锡为IVA族元素,锡的单质和化合物与某些物质在化学 性质上有许多相似之处。
性质上有许多相似之处。
(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相 应的变化,试写出有关反应的化学方程式: 。
应的变化,试写出有关反应的化学方程式: 。
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(写分子式) 。
(3)若向(1)中所 得溶液中加入适量的NaOH
得溶液中加入适量的NaOH 溶液,产生白色沉淀(该沉淀物的分子中含2个氢原子),再加过量的NaOH溶液,白色沉淀溶解。上述反应类似于AlCl3溶液的相应反应,试写出有关反应的离子方程式: 。
溶液,产生白色沉淀(该沉淀物的分子中含2个氢原子),再加过量的NaOH溶液,白色沉淀溶解。上述反应类似于AlCl3溶液的相应反应,试写出有关反应的离子方程式: 。
(4)已知锡元素具有如下性质:①Sn4++Sn=2Sn2+;②2Sn2++O2+4H+=2Sn4++2H2O;③Sn(OH)2与HCl以1 : 2的物质的量比反应后的溶液略带浑浊;④2H++SnO22-- Sn(OH)2
Sn(OH)2 Sn2++2OH--,试回答:用SnCl2固体配制并保存SnCl2溶液的方法是 ,若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是 。
Sn2++2OH--,试回答:用SnCl2固体配制并保存SnCl2溶液的方法是 ,若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是 。
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
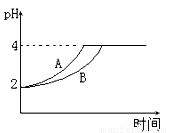
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度 下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分 析该溶液遇酚酞呈红色原因时,
析该溶液遇酚酞呈红色原因时, 甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。
甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。 请你设计一个
请你设计一个 简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目: 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:推断题
【化学——选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)W+的电子排布式为 ,Y2X2分子中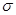 键与π键数之比为 。
键与π键数之比为 。
(2)化合物ZX3比YX4易液化,主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是 。
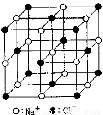
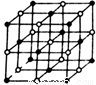
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ;如果该晶体的密度为d g·cm--3,阿伏加德罗常数为NA,则晶体中两个距离最近的氯离子中心间的距离为 cm。
(5)ZX3的VSEPR构型为 ,ZF3分子的空间构型为 ;ZX3容易与W2+形成配离子,但ZF3不易与W2+形成配离子,其原因是 _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com