
科目: 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:实验题
活性氧化锌是一种多功能性的新型材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
步骤II中,在酸性溶液中加入KMnO4的作用是将Fe2+ 氧化成Fe3+,离子方程式为 ;
(2)用ZnO调节pH,以除去含铁杂质。检验沉淀是否完全的实验操作是 ;调节pH的适宜范围是 。
(3)步骤III中加入Zn粉的作用是① ,②进一步调节溶液PH值。
(4)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
取1.000g活性氧化锌,用15.00mL 1.00mol/L硫酸溶液完全溶解,滴入几滴指示剂,再用0.50mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL,通过计算可以得到活性氧化锌的纯度,由表中Zn(OH)2PH变化可知,滴入的最理想的指示剂是 (填“酚酞”、“甲基橙”或“石蕊试剂”)。
查看答案和解析>>
科目: 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:实验题
硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)浓硫酸与稀硫酸相比较,浓硫酸具有 。
(2)该反应的化学方程式为 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是_________________。
(4)得到的混合液可以用下列四种物质中的_______调节pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
A.NaOH B.CuO C.CuCO3 D.Fe
(5)请根据以上内容,对这两个实验方案进行评价,填下表:(至少写一点)
实 验 (一) | 实 验 (二) | |
主要优 点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
主要缺 点 |
查看答案和解析>>
科目: 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:实验题
以下是实验室对中草药中可能残余的有毒元素砷的检验步骤(As在中草药中主要以As2O3形式存在):
① 取1000g样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
② 将待测溶液转移至250mL锥形瓶中,并滴入2~3滴0.2%的淀粉溶液;
③ 用浓度为1.5×10-3mol/L的标准碘溶液滴定待测溶液至终点,消耗20.25ml标准I2溶液,发生反应:H3AsO3+I2+H2O→H3AsO4+I-+H+(未配平):
(1)对少量中草药样品进行前期处理制得待测溶液的操作过程是:取少量样品于坩埚内灼烧成灰, 。
(2)配平:______H3AsO3+______I2 +______H2O = ______H3AsO4+_______I-+_______H+
(3)0.2%的淀粉溶液的作用是_______,如何判断滴定到达终点?________。
(4)实验室用一定量的KIO3和过量的KI以及酸混合反应制得的标准碘溶液,该反应的离子反应方程式为_____________________。
(5)我国药用标准限定:中药的砷含量不超过2.000mg/kg,通过计算可知,该样品砷含量约为_______mg/kg,故该草药样品________(“合格”或“不合格”)。(相对原子质量As-75)
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
化学无处不在,下列与化学有关的说法错误的是
A.生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼
B.古方记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化
C.绿色化学的核心是减少和消除工业生产对环境的污染
D.通过煤的干馏、气化、液化能获得多种化工原料
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
乌洛托品在工业生产中有广泛用途,其结构式如图所示。下列说法正确的是
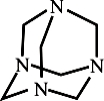
A.化学式为C6H12N4,属于饱和烃
B.不能发生加成反应,一氯取代产物有3种
C.分子中既含极性共价键又含非极性共价键
D.可由甲醛(HCHO)与氨气按物质的量之比3∶2完全反应制得
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
25℃时,关于指定溶液说法正确的是
A.pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2-
B.1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA
C.1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色
D.SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
原子序数依次增大的短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数。下列叙述正确的是
A. A元素形成的双原子分子A2最多有3种
B. 化合物BC2的电子式为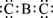
C. B、C、D三种元素的非金属性强弱顺序为C>D>B
D. 化合物A2C的沸点高于A2D是因为C—A键比D—A键稳定
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
25℃时,用0.1000 mol·L-1 KOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是
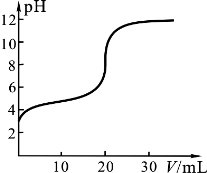
A.V=0.00mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol·L-1
B.V=10.00mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-)
C.溶液pH=7时,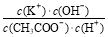 =1
=1
D.V≥20.00mL时,溶液中c(K+)=c(CH3COO—)+c(OH-)+c(CH3COOH)
查看答案和解析>>
科目: 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”。工作原理如图,已知反应的离子方程式:VO2++V3++H2O VO2++V2++2H+。下列叙述错误的是
VO2++V2++2H+。下列叙述错误的是
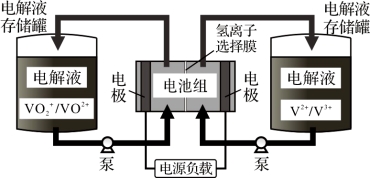
A.放电时,正极电极反应为:VO2++e-+2H+=VO2++H2O
B.充电时,阴极电极反应为:V3++e-=V2+
C.放电时,H+从电池右边移向左边
D.利用该电池电解饱和NaCl溶液(石墨作电极),2 mol VO2+发生氧化反应时,可生成气体44.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com