
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g)  2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中—定能大量共存的是
A. 由水电离的H+离子浓度等于10-12mol/L的溶液中:Na+ 、K+、NO3-、HCO3-
B. pH=l的溶液中:Fe2+、NO3-、SO42-、Na+、
C. 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+
D. c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A. 氯化银、溴化银和碘化银的溶解度依次增大
B. 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C. 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3 mol/L的AgNO3溶液,能观察到白色沉淀
D. 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成窗体顶端
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
不能用勒夏特列原理解释的是
①打开雪碧的瓶盖,立即有气体逸出
②由H2、I2、HI三种气体组成的平衡体系加压后颜色变深
③可用浓氨水和氢氧化钠固体混合来快速制氨
④煅烧粉碎的硫铁矿有利于SO2生成
⑤使用铁触媒,使N2和H2的混合气体有利于合成NH3
⑥将混合气体中的氨气液化有利于合成氨反应
⑦500℃左右比室温更有利于合成NH3
⑧配制FeCl2溶液时加入少量铁屑
⑨实验室常用排饱和和食盐水法收集Cl2
A. 3项 B. 4项 C. 5项 D. 6项
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)  xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
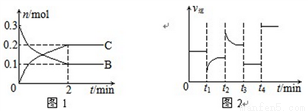
下列有关说法正确的是
A. x=2,反应开始2 min内,v(A)=0.05 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
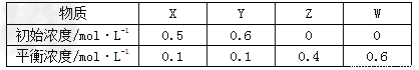
A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为K=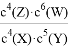
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol/LCH3COONa溶液与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2/3 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
如图所示,其中甲池的总反应式为::2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是
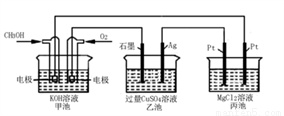
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:简答题
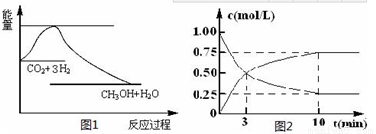
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________;
②下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度B.将CH3OH(g)及时液化抽出C.选择高效催化剂D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com