
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:简答题
(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g) 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
则 CO的燃烧热 ΔH =_________。
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________
(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。
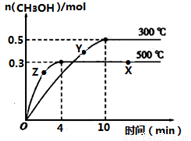
②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:简答题
低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
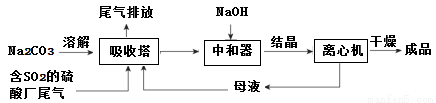
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施______________、_______________。(写出两条)
(2)中和器中发生的主要反应的离子方程式是_____________________。
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。

①则初期反应(图中A点以前)的化学方程式是__________________。
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
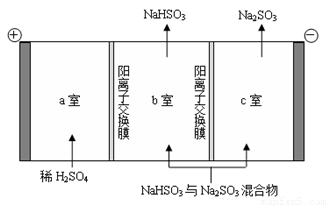
简述分离NaHSO3与Na2SO3混合物的原理___________________。
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是______

A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:简答题
钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2•H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。
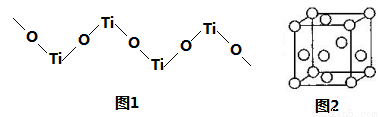
(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为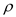 g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:推断题
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
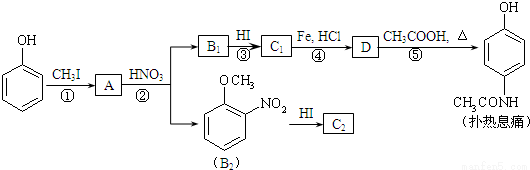
已知: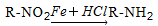 ,请按要求填空:
,请按要求填空:
⑴写出A分子中官能团名称:_________;C1的结构简式为:________________。
⑵写出由D生成扑热息痛的化学方程式:_______________________。
⑶写出反应③和④的反应类型:③______________,④__________。
⑷工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:______________________。
⑸扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(I)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是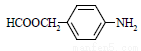 和
和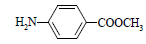 ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g)  2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
废电池造成污染的问题日益受到关注。下列有关电池的说法正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 弱电解质在水中的电离程度报小,不能用作电池的电解质溶液
C. 原电池是将化学能完全转变为电能的装置
D. 回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
铜锌原电池(如图)工作时,下列叙述正确的是
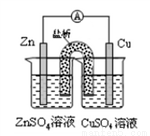
A. 在外电路中,电流从Zn极流向Cu极 B. 盐桥中的Cl-移向CuSO4溶液
C. 当负极减小65g时,正极增如65g D. 电池的总反应为Zn+Cu2+=Zn2++Cu
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A. NH4+的水解反应离子方程式:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
B. 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C. 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D. 某反应△H<0,则该反应在任意条件下均可自发进行
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
在一定温度下,下列叙述是可逆反应A(g)+3B(g) 2C(g)在定容密闭容器中达到平衡的标志的是
2C(g)在定容密闭容器中达到平衡的标志的是
①C的生成速率与C的分解速率相等;
②单位时间内amol A生成,同时生成3amol B;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化。
A. ②⑤ B. ①③④⑤ C. ②⑥⑦⑧ D. ⑤⑥⑧
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
下列实验误差分析正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取滴定溶液体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com