
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
目前有四个实验方案,可行的是
A. 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤
B. 分离汽油和煤油 ,可用萃取的方法
C. 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
下列离子反应方程式,书写正确的是
A. 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑
B. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-=Cu(OH)2+SO42-
氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O
C. 硝酸银与氯化:AgNO3+Cl-═AgCl↓+NO3-
D. 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
关于有机物的性质,下列说法不正确的是
A. CH4气体能与Cl2在光照条件下发生取代反应生成CCl4
B. CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应
C. 通常情况下,苯是无色气体,能在催化剂条件下与Br2发生单取代反应
D. 乙醇和乙酯发生酯化反应生成乙酸乙酯是可逆反应
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
带有充满电解质KCl的饱和溶液盐桥的锌铜原电池工作时,下列叙述不正确的是
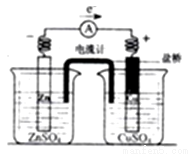
A. 用还原性较强的物质做为负极,负极向外提供电子:用氧化性较强的物质作为正极,正极从外电路得到电子
B. 盐桥中的K+会移向ZnSO4溶液,Cl-移向CuSO4溶液,使两个半电池保持中性
C. 盐桥的引入,解决了Zn直接与CuSO4溶液反应降低原电池工作效率的问题
D. 放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
对已经达到化学平衡的反应2X(g)+Y(g)  2Z(g), △H<0
2Z(g), △H<0
A. 减小压强时,正、逆反应速率都减小,平衡向正反应方向移动
B. 降低温度时,正、逆反应速率都减小,平衡向逆反应方向移动
C. 恒容时,充入稀有气体,Y的转化率变大
D. 此反应为熵减反应,△S<0
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
MOH是强碱溶液与等体积、等浓度的HA弱酸溶液混合后,下列叙述不正确的是
A. 弱酸的电离常数越小,其所产生的盐水解的程度越大
B. 溶液中发生的水解反应是A-+H2O HA+OH-
HA+OH-
C. 有关离子浓度大小关系是c(M+)>c(A+)>c(OH-)>c(H+)
D. 该溶液是酸性
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:实验题
凯里一中2018届高一(1)班的两名同学用酸碱中和滴定的方法测定烧碱溶液的浓度。过程如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且30秒内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗盐酸为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察______________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)锥形瓶中的溶液从_______色变为_______色时,且30秒种不变化,停止滴定。
(3)该小组在步骤中①错误是______________,由此造成的测定结果分别是_______,(填偏高、偏低或无影响)。
(4)步骤②缺少的操作是______________________。
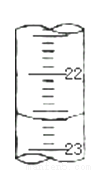
(5)如下图,是某次滴定时的滴定管中的液面,则其读数为_______mL。
(6)根据下列数据
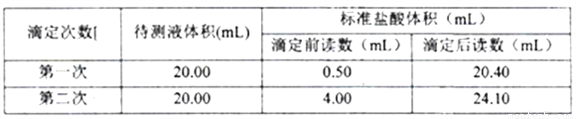
请计算待测烧碱溶液的浓度为______________mol/L。
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:简答题
汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮颗粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等,一辆轿车一年排放的有害废气比自身重量大3倍。其中NO气体是由于内燃机燃烧的高温引起N2和O2反应所致:N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是____________。
(2)恒容条件下,判断该反应达到平衡的标志是________。(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
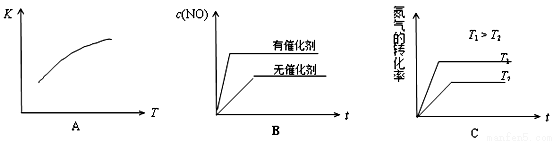
(4)可逆反应N2(g)+O2(g) 2NO(g)的平衡常数表达式为____________。温度升高,平衡常数将会
2NO(g)的平衡常数表达式为____________。温度升高,平衡常数将会
_____________(填“增大、或“减小”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(6) 火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式____________________。
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:简答题
铜是人类最早使用的金属之一,中国使用铜的历史年代久远。大约在六、七千年以前中国人的祖先就发现并开始使用铜。纯铜是柔软的金属,呈紫红色,延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,请回答下列问题:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______(填选项字母)
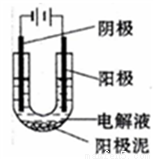
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(2)目前的电路板,主要由线路和图面组成,线路是作为原件之间导通的工具,在设计上会另外设计大铜面作为接地及电源层,在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为______________。
(3) Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式___________________。
(4)Cu2O中的Cu+不稳定,向Cu2O滴加稀硫酸,有紫红色物质生成,溶液变为蓝色,写出反应的离子方程式_________________。
(5)火法炼铜的原理:Cu2+O2 2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
查看答案和解析>>
科目: 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:简答题
在常温下,下列五种溶液:
①0.1mol/LNH4Cl ②0.1mol/LNH4HSO4 ③0.1mol/LCH3COONH4
④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液 ⑤0.1mol/LNH3·H2O
请根据要求填写下列空白:
(1)溶液①是______性(填“酸”、“碱”或“中”),其原因是____________(用离子方程式表示)
(2)比较溶液②、③这C(NH4+)的大小关系是___________(填“>”、“<”或“=”)
(3)在溶液④中,__________离子的浓度为0.1mol/L;NH3·H2O和_________离子的物质的量浓度之和为0.2mol/L。
(4)室温下测得溶液③的PH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”), NH4+的水解程度,C(CH3COO-)__________C(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com