
科目: 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:实验题
已知:CH3Cl常温下为气态,难溶于水,易溶于乙醇等有机溶剂,实验室制备CH3Cl原理为:CH3OH+HCl(浓) 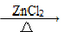 CH3Cl(g)+H2O
CH3Cl(g)+H2O
(1)实验步骤如下:
①干燥ZnCl2晶体。实验室干燥ZnCl2晶体制得无水ZnCl2的方法是____。
②称取13.6g研细的无水ZnCl2,量取20mL浓盐酸、一定量的CH3OH,分别放入装置______(填装置编号)的对应仪器中;
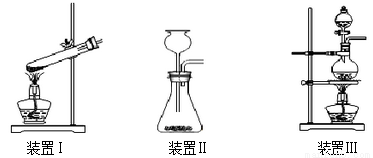
③产生的CH3Cl气体,最好选用排水法收集,原因是___________。
(2)为探究CH3Cl与CH4分子稳定性的差别,某化学兴趣小组设计实验验证CH3Cl能被强氧化剂酸性高锰酸钾溶液氧化。
①将CH3Cl制备装置中产生的气体依次通过以下三个洗气瓶______(按顺序填洗气瓶编号),如果观察到A中紫色褪去的实验现象则证明CH3Cl稳定性弱于CH4。
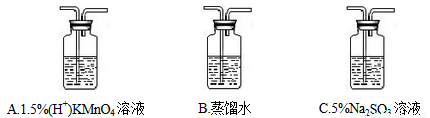
②实验过程中发现,洗气瓶A中紫色褪去了,并产生一种黄绿色气体和一种无色气体,则其发生反应的离子方程式:_________; 洗气瓶C中发生反应的离子方程式:____________。
③为处理未反应完的CH3Cl,还应在上述洗气瓶后接一只盛_________(填试剂名称)的洗气瓶。
查看答案和解析>>
科目: 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
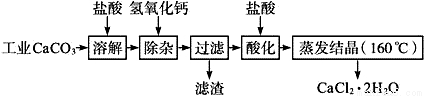
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
查看答案和解析>>
科目: 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
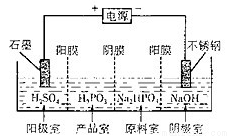
阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
查看答案和解析>>
科目: 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
(一)硒元素(selenium)是第四周期、第VIA族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显著的光电效应,可应用于光电半导体材料。请回答下列问题:
(1)Se原子的核外电子排布式为[Ar]_____。
(2)As和Se是同一周期的元素,As的第一电离能比Se大,原因是______。SeO42-中Se―O的键角比SeO3的键角________(填“大”或“小”)。
(3)H2Se比H2S水溶液的酸性强,原因是_____,____。
(4)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
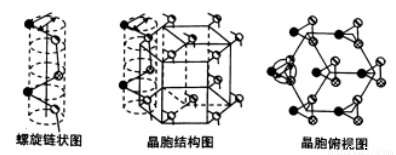
螺旋链中Se原子的杂化方式为____________。
(二)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色Cu2O,其晶胞结构如图所示。
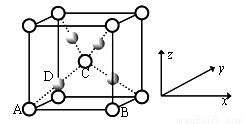
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(1/2,1/2,1/2)。则D原子的坐标参数为_________,它代表铜原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目: 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】
1,6—己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如下:
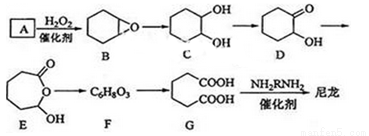
回答下列问题:
(1)写出化合物C的系统命名_________ ;化合物A通过质谱测得相对分子质量为82,则A的化学名称为__________。
(2)C→D的反应类型为__________。
(3)F的结构简式为__________。
(4)写出能同时满足下列条件的X的同分异构体的结构简式___________。
①相对分子质量与F相等
②烃的含氧衍生物,能发生银镜反应
③核磁共振氢谱中有三组峰,面积比为3:2:1
(5)由G合成尼龙的化学方程式为__________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线为_______。
查看答案和解析>>
科目: 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列物质用途不正确的是
A. Na2O2 是强氧化剂,有漂白性,可用作食品的漂白剂
B. Al2O3熔点很高,可用作耐火材料,制作耐火管和耐火坩埚
C. NaHCO3能与酸反应,可制成胃药治疗胃酸过多
D. Fe2O3是红棕色固体,可用作红色油漆和涂料
查看答案和解析>>
科目: 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. Na与氧气反应因氧气用量不同,产物不同
B. Na2O和Na2O2中阳阴离子物质的量之比均为2:1
C. Na2CO3和NaHCO3的水溶液都呈碱性,它们都属于碱
D. Na2O和Na2O2都能与水反应生成对应的碱,它们都属于碱性氧化物
查看答案和解析>>
科目: 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列实验操作或事故处理中,做法正确的是
A. 用稀硫酸清洗做焰色反应的铂丝
B. 新配硫酸铁溶液要加入铁钉和稀硫酸保存
C. 用剩的金属钠要放回原试剂瓶中,不能随意丢弃
D. 大量金属钠着火可以用干粉(含NaHCO3)灭火器灭火
查看答案和解析>>
科目: 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列各组会出现先产生沉淀,然后沉淀再溶解的现象的是
A. 向NaOH溶液中逐滴滴入Al2(SO4)3溶液至过量
B. 向NaAlO2溶液中通入CO2气体至过量
C. 向NaHCO3溶液中逐滴滴入NaOH溶液至过量
D. 向NaAlO2溶液中逐滴滴入盐酸至过量
查看答案和解析>>
科目: 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数值为NA,则下列说法正确的是
A. 1.8g的NH4+离子中含有的电子数为NA
B. 含1molFeCl3的饱和溶液滴入沸水中制得的Fe(OH)3胶体,此胶体中含有Fe(OH)3胶粒数为NA
C. 7.8g Na2O2与CO2完全反应转移电子数为0.2NA
D. 4.6g Na投入100mL 1mol/L盐酸中产生氢气分子数为0.05NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com