
科目: 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:计算题
燃烧法是测定有机化合物化学式的一种重要方法。现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6 g,乙装置增重8.8 g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍。
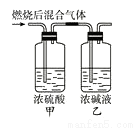
回答下列问题:
(1)该烃的相对分子质量是______________,分子式是__________。
(2)若该烃为链状烃,写出所有同分异构体的结构简式(不考虑顺反异构)________________。
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
现代生活需要人们有一定的科学素养,下列有关化学的科学常识正确的是
A. 铝的钝化、煤的气化、漂白粉杀菌消毒过程均有化学反应发生
B. 碳酸钠可用于治疗胃酸过多、制备食品发酵剂
C. 浓硫酸可刻蚀石英制艺术品
D. 氢氧化铁溶胶、淀粉溶液、NaCl溶液均具有丁达尔效应
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
以下有机物的说法正确的是
A. CH2=CH—COOH能发生取代反应、加成反应、水解反应
B. 石油分馏产品经过裂解、加成可制得1,2—二溴乙烷
C. 分子式为C4H8O2的酯有3种
D. 硬脂酸甘油酯、淀粉、蛋白质均是可发生水解反应的高分子化合物
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 常温常压下,22.4LNH3中存在共价键的总数为3NA
B. 100g46%的乙醇溶液中含有氢原子数为12NA
C. 0.1mol氯气溶于水和水反应,转移的电子数为0.1NA
D. CH3COONa溶液中,若CH3COO?的数目为NA,则Na+的数目为NA
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
a、b、c、d为原子序数依次增大的短周期元素,c?的电子层结构与氖相同,化合物ac易溶于常见液体a2b,d的化合物灼烧时火焰呈黄色,下列有关叙述错误的是( )
A. 元素的非金属性次序为c>b>a B. d和其他3种元素均能形成离子化合物
C. 化合物acb中c元素的化合价为+1价 D. 元素a、b、d组成的固体化合物中存在离子键和共价键
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
一定条件下,利用如图装置可实现有机物的储氢,下列有关说法正确的是( )

A. 苯在电极D放电时断开的化学键是极性键
B. 气体X在反应中通常体现还原性
C. 若阳极区的电解质溶液为稀硫酸,则电解一段时间后,阳极区溶液的pH增大
D. 电极D的电极反应式为C6H6+6H++6e-===C6H12
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )
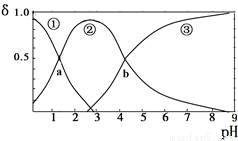
A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:简答题
CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。
【查阅资料】
①
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
⑴配平潮湿CuCl在空气中被氧化的化学方程式_________
____CuCl+_____O2+_____□=_______3CuO·CuCl2·3H2O+______HCl
【实验探究】该小组选用下图装置进行实验(夹持加热仪器略)。
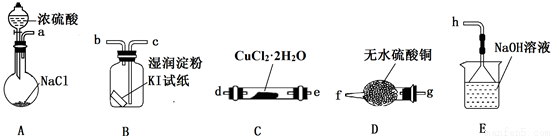
⑵装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和_________性;
⑶按实验要求选择上图装置,连接顺序为:a_______(按气流方向,用小写字母表示);
⑷根据完整的实验装置进行实验,实验步骤如下:
①连接装置,_______;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;…
步骤①是__________________;步骤④通HCl的目的是_________________;
⑸装置E中发生反应的离子方程式是______________________。
【实验分析与改进】
⑹装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:_____________________
⑺反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_________________。
查看答案和解析>>
科目: 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:填空题
锡(Sn)是一种重要的金属,纯锡可用于作超导材料、半导体。锡元素位于周期表第5周期,第IVA族。
⑴锡在化合物中常见的化合价有两种:+2和_________。
⑵锡既能与盐酸也能与NaOH溶液反应,生成的盐都是含+2价的锡,写出锡与NaOH溶液反应的离子方程式_____________________________。
⑶如图是工业冶炼锡的基本流程:
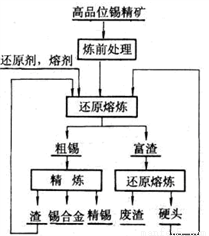
①炼前处理包含锡精矿(主要含锡、铁、铜、铅的硫化物和砷化物)在空气中焙烧及流程,使硫和砷元素转化为易挥发的SO2和As2O3,请写出砷磁黄铁矿(FeAsS2)焙烧生成红棕色固体的化学方程式______________,生成的气体用过量的NaOH溶液吸收,则溶液中的浓度最大的含氧酸根离子是_______
②还原熔炼的反应原理为:SnO2(s)+2CO(g) Sn(s)+2CO2(g),一定温度下,在固定容积的密闭容器中,SnO2与CO反应,平衡后容器内气体的平均摩尔质量为37.6,该温度下的平衡常数K=____________
Sn(s)+2CO2(g),一定温度下,在固定容积的密闭容器中,SnO2与CO反应,平衡后容器内气体的平均摩尔质量为37.6,该温度下的平衡常数K=____________
③粗锡中主要含有Fe、Cu、Pb、Sb金属,常采用电解精炼方法获得精锡。其中SnSO4溶液作电解液,精锡连接电源的______极,检测可知电解后阳极泥中含有Sb、Cu、PbSO4等,则电解过程中阳极电极反应式为________________________________________。
④精炼后产生的渣及还原熔炼产生的硬头中一定含有的元素是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com