
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于现象的说法正确的是( )
A. 向某溶液中加入氯水再滴加KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B. 取某溶液进行焰色反应,透过蓝色钻玻璃焰色为紫色,则原溶液的溶质一定是KNO3
C. 向某溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液不一定含有SO42-
D. 往Na2CO3和NaHCO3溶液中滴加酚酞都变红,说明Na2CO3和NaHCO3都是碱
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应Fe3+的物质的量之比为
A. 1:1 B. 1:2 C. 2:3 D. 3:2
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
关于Na2O和Na2O2的叙述正确的是( )
A. 都是白色的固体 B. 都能和水反应形成强碱溶液
C. 都是碱性氧化物 D. 焰色反应的颜色都是紫色
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知有如下反应:① 2BrO3-+Cl2=Br2+2ClO3-
②ClO3-+5Cl-+6H+=3Cl2+3H2O
③2FeCl2+Cl2=2FeCl3
根据上述反应,判断下列结论中错误的是( )
A. Cl2在反应②中既是氧化产物又是还原产物
B. 氧化性强弱的顺序为:BrO3->ClO3-> Cl2>Fe3+
C. 溶液中可发生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
D. Cl2在①、③反应中均作氧化剂
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A. 锌与镁 B. 铁与锌 C. 铝与铁 D. 镁与铁
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下配制溶液叙述正确的是( )
A. 配制一定物质的量浓度溶液时,若加水超容量瓶刻度应用胶头滴管将多余溶液吸出
B. 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大
C. 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中
D. 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A. 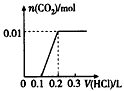 B.
B. 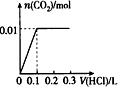
C. 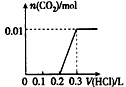 D.
D. 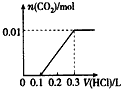
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
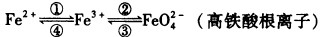
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______,生成1molNa2FeO4转移电子数目为__________。
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是______;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________ 。
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法,并写出相应离子方程式:__________。
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
(1)机智如化学老师的你用固体烧碱配制500mL 0.20 mol L-1的NaOH溶液,需要称取____g固体,定容时除了胶头滴管和玻璃棒,还需要的仪器为______。
(2)语文老师要用36.5% (ρ=1.18g cm-3)的浓盐酸配制0.4 mol L-1的盐酸240 mL,需准确量取36.5%的浓盐酸____mL。
(3)若配制0.5mol L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,下列所配制的硫酸溶液浓度偏低的是_______(填序号)。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.移液时容量瓶中有少量蒸馏水。
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
E.稀释后没冷却到室温就将溶液转移至容量瓶。
查看答案和解析>>
科目: 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
用下面两种方祛可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)制取所需的FeSO4溶液需要的反应物为_______。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________。
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
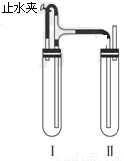
(3)在试管Ⅰ里加入的试剂是________________________________________。
(4)在试管Ⅱ里加入的试剂是________________________________________。
操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为:_____________。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com