
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
有机物M、N、Q之间的转化关系为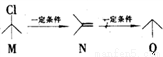 ,下列说法正确的是
,下列说法正确的是
A. M的同分异构体有3种(不考虑立体异构)
B. N分子中所有原子共平面
C. Q的名称为异丙烷
D. M、N、Q均能与Br2反应
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列实验中,操作和现象均正确且能实现相应实验目的的是
选项 | 实验目的 | 操作 | 现象 |
A | 验证BaSO3难溶于水 | 将SO2通人Ba(NO3)2溶液中 | 有白色沉淀生成 |
B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
D | 验证某化合物一定是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
银-Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与Feirozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是
A. ①中,负极上消耗1 mol甲醛时转移2 mol电子
B. ①溶液中的H+由正极移向负极
C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4
D. ④中,甲醛浓度越大,吸光度越小
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
有关下列图像的分析正确的是
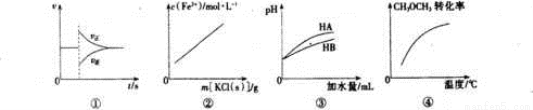
A. 图①可表示反N2(g)+3H2(g)  2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
B. 图②表示FeCl3溶液和KSCN溶液反应达平衡后,向该混合液中逐渐加人固体KCl的过程中C(Fe3+)的变化趋势(忽略溶液体积变化)
C. 图③表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D. 图④表示密闭容器中CH3OCH3(g)+3H2O(g)  6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
甲、乙两化学小组拟根据氨气还原氧化铜反应的原理测定某铜粉样品(混有CuO粉未)中金属铜的含量。
(1)甲小组利用下图装置(可以重复选用),通过测定反应生成水的质量来达到实验目的。
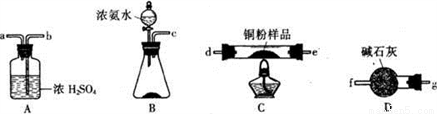
①按气流方向连接各仪器接口,顺序为______________(填小写字母序号)。
②装置B中固体试剂的名称为____________________。
③装置A的作用为____________。
④下列两步操作应该先进行的是___________(填序号):i.加热反应管 ii.向锥形瓶中逐滴滴加浓氨水,原因为________________________。
(2)乙小组利用上述装置通过测定反应前后装置C中固体的质量变化来达到实验目的。
①按气流方向连接各装置,顺序为______________(填大写字母序号)。
②称取m1 g铜粉样品,测得反应前装置C的质量为m2 g,充分反应后装置C的质量为m3g。写出样品中金属铜的质量分数表达式__________________。
(3)从稀盐酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,重新设计一个测定样品中金属铜含量的实验方案(写出主要步骤,不必描述操作过程的细节)_____________________________。
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
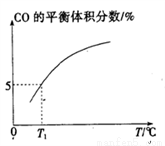
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α= ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
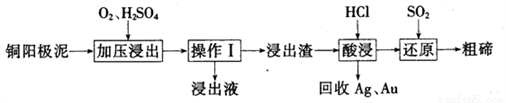
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
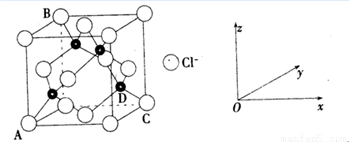
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:推断题
高分子树脂M具有较好的吸水性,其合成路线如下:
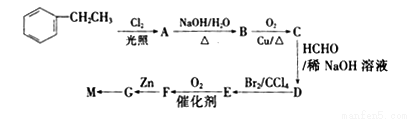
已知: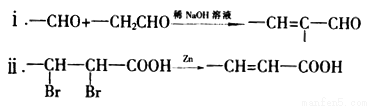
(1)C的名称为______________,D中的官能团为__________________,结构简式为_____________。
(2)由A生成B的化学方程式为___________________。
(3)上述合成路线中,D→E转化在合成M中的作用为___________________________。
(4)下列关于F的叙述正确的是___________。
A.能与NaHCO3反应生成CO2 B.能发生水解反应和消去反应
C.能聚合成高分子化合物 D. 1 mol G最多消耗2 mol NaOH
(5)H是G的同系物,且与G相差一个碳原子,则同时满足下列条件的H的同分异构体共有______种(不考虑立体异构)。
①与G具有相同的官能团 ②苯环上只有两个取代基
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选),设计制备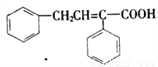 的合成路线_________________________。
的合成路线_________________________。
查看答案和解析>>
科目: 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列有关燃料的说法错误的是
A. 含硫化石燃料的大量燃烧是形成酸雨的主要原因
B. 绿色化学的核心就是对已造成的环境污染进行彻底治理
C. 以压缩天然气代替汽油可减少大气污染
D. 煤经干馏、气化和液化,可获得洁净的燃料和多种化工原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com