
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案,请回答下列问题:
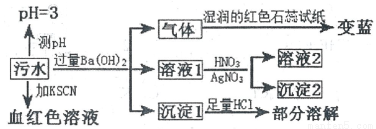
下列说法正确的是
A. 该污水中一定存在Fe3+,不存在Fe2+ B. 沉淀l为BaCO3和BaSO4
C. 沉淀2可能为AgCl和Ag2SO4 D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:推断题
A是一种常见的烃,相同条件下相对氢气的密度为13,D能与小苏打反应产生气体,它们之间存在如下图所示的转化关系(反应所需条件已略去):
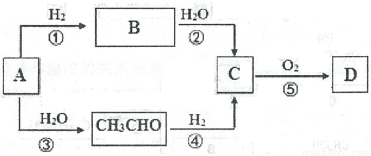
请回答:
(1)D中含有官能团的名称是________________。
(2)反应⑤发生的条件是加热和催化剂,其化学方程式为________________。
(3)检验乙醛中所含官能团可以选用的试剂是________________。
(4)下列说法正确的是________________。
a.上述反应中属于加成反应的只有①和④ b.除去C中含有D可加生石灰蒸馏
c.工业上获得大量B可通过石油裂化工艺 d.等物质的量B和C完全燃烧耗氧量相同
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:填空题
为了确定黄钾铁矾[KFe3(SO4)x(OH)y]的化学式,某兴趣小组设计了如下实验:
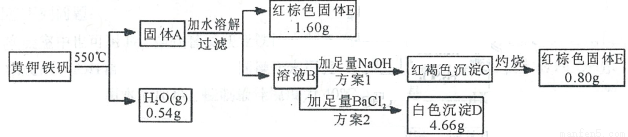
请回答:
(1)黄钾铁矾的化学式[KFe3(SO4)x(OH)y]中x=________,y=________。
(2)写出溶液B中所含溶质的化学式________。
(3)红褐色沉淀能溶于HI溶液,并发生氧化还原反应,写出该反应的离子方程式________。
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:实验题
为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
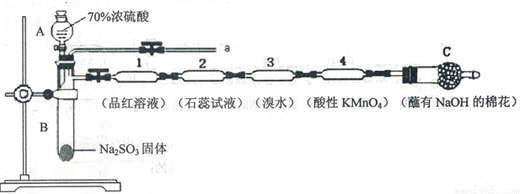
请回答:
(1)仪器A的名称是_________________。
(2)装置C中NaOH的作用是_________________。
(3)下列说法正确的是_________________。
A.装置l、3、4中溶液均褪色,可证明SO2具有漂白性
B.装置2中石蕊试液只变红不褪色,证明SO2是一种酸性氧化物
C.反应结束后,可由a导管向装置中加水,将气体赶出后再拆装置
D.在a导管处用向下排空气法收集SO2
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:计算题
将6.40g CuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.40g;另一份固体用200mL某浓度的盐酸恰好溶解,则:
(1)混合物中CuO和Fe2O3的物质的量之比为_______________。
(2)所用盐酸的物质的量浓度为_______________。
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:填空题
氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g)  2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g)  2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
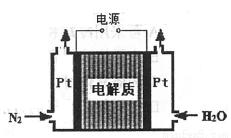
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。
(3)反应:2NO(g)+O2(g) 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
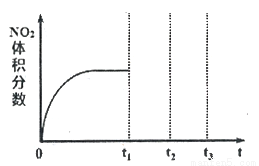
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g)  N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g)  2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:简答题
三草酸合-铁(III)酸钾K3 [Fe(C2O4)3]·3H2O (Mr=491)为绿色晶体,易溶于水,难溶于乙醇等有机溶剂。110℃下可失去结晶水,230℃时即分解,是制备负载型活性铁催化剂的主要原料。以硫酸亚铁铵为原料制备三草酸合铁(III)酸钾晶体的流程如下所示:
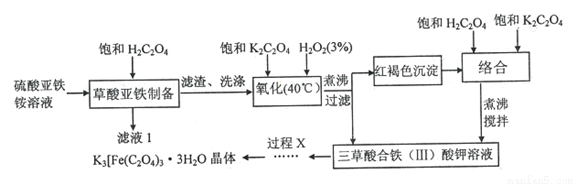
请回答下列问题:
(1)实验室中也可用Fe3+盐代替硫酸亚铁铵来制备该晶体,需先用碱液沉淀Fe3+,若用同浓度的NaOH溶液或氨水通过相同操作来沉淀,选择______能获得颗粒较大的Fe(OH)3。
(2)氧化过程中采用水浴加热,控制最佳温度为40℃,理由是_______,发生反应的化学方程式为_______。氧化完全后需将所得溶液煮沸,目的是__________________。
(3)关于过程X的下列说法中不正确的是________________。
A.可采用冷却和向溶液中加入乙醇的方法促使晶体析出
B.为了快速得到较干燥的固体,可以采用抽滤的方法
C.洗涤晶体时,可先用少量水洗,再用乙醇洗
D.可用加热烘干的方法得到较干燥的晶体
(4)为了分析产品纯度,进行如下操作:
准确称取产品0.9350g,配制成250mL溶液。每次移取25.00mL置于锥形瓶中,加入足量稀H2SO4酸化,将C2O42-转化为H2C2O4,用0.0100mol/LKMnO4溶液滴定至终点,现象是_______。平行测定三次,消耗KMnO4的体积分别为20.02mL,19.98mL,20.00mL,则所得粗产品的纯度为_________________。(已知:5 H2C2O4+2 MnO4-+6H+=10CO2↑+2Mn2++8H2O)
查看答案和解析>>
科目: 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:推断题
以对羟基苯甲醛为原料,合成降血脂药物环丙贝特的流程图如下:

已知: 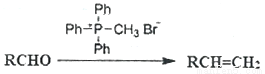
请回答下列问题:
(1)下列说法不正确的是___________。
A.环丙贝特分子中存在2个手性碳原子 B. D的分子式为C14H16Cl2O3
C.C中含有的官能团有醚键、酯基和碳碳双键 D.反应②③⑤均为取代反应
(2)B的结构简式为____________ 。
(3)写出A与足量溴水反应的化学方程式为____________ 。
(4)请写出符合下列条件的A的所有同分异构体的结构简式____________ 。
i分子中含有苯环,不含其他环状结构
ii 1H-NMR谱显示共有4个峰
(5)已知:①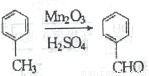
②苯环上有甲基时,新取代基主要取代在邻位或对位,有醛基时主要取代在间位。请写出以甲苯为原料合成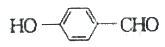 的流程图,其他无机原料任选。__________________
的流程图,其他无机原料任选。__________________
(合成路线常用的表示方式为: )
)
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
化学与生活、环境密切相关,下列说法正确的是
A. 可以用淀粉检验加碘食盐中是否含有碘元素
B. 适量饮酒对身体有利的原因是酒精不能使蛋白质变性
C. PM2.5亦称可入肺颗粒物,表面积大,能吸附有毒有害物质
D. 使用生物酶降解生活污水中的有机物,可以防止水体富营养化
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最高价氧化物对应的水化物化学式为H2XO3 |
Y | Y是地壳中含量最高的元素 |
Z | Z元素的原子最外层有3个电子 |
W | W的一种核素的质量数为28,中子数为14 |
则相关判断正确的是
A. W原子半径大于Z
B. 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键
C. 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象
D. W的单质与氢氟酸反应生成两种无色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com