
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
用石墨电极电解CuCl2溶液(装置右图所示),下列相关分析正确的是
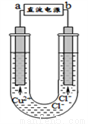
A. a端是直流电源的正极
B. 阴极上发生的反应:Cu2++2e-=Cu
C. 通电使CuCl2发生电离
D. 通电一段时间后,在阴极附近观察到黄绿色气体
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
在0.1 mol·L-1的NaHCO3溶液中,下列关系正确的是
A. c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B. c(Na+)=c(HCO3-)>c(OH -)>c(H+)
-)>c(H+)
C. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D. c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
(1)刘安《淮南万毕术》中“曾青得铁则化为铜”是古代湿法炼铜的真实写照。除去CuSO4溶液中少量的Fe2+,可以按照下面的流程进行:
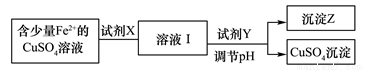
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下表:
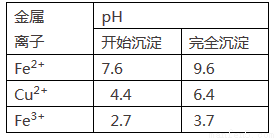
①下列物质中适合作为试剂X的是____________
A.H2O2 B.KMnO4
C.HNO3 D.Cl2
②加入的Y及调节的pH范围是_____________
A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0
(2)已知常温下,Ksp[Cu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于_________。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
根据下列电化学装置,回答下列问题:
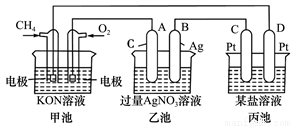
(1)图中甲、乙池的名称:甲池是__________装置,乙池是__________装置。(填“原电池”或“电解池”)
(2)A(石墨)电极的名称是____________。
(3)通入CH4一极的电极反应式为___________________________________。
(4)乙池中的电解方程式为___________________________________________。
(5)当乙池中B极的质量增加5.4 g时,甲池中理论上消耗O2_____mL(标准状况下)。此时丙池某电极析出1.6 g某金属,则丙池溶液中的溶质可能是___________(填序号)。
A.MgSO4 B.CuSO4 C.Na2SO4
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
(1)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=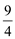 ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol·L-1 | 0.10 | 0.10 | 0.20 |
①10 min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=___________。
②丙达到平衡所用的时间_______10 min(填“<”、“>”、“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_______________。
(2)研究铁及其化合物对生产生活具有重要的意义。一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
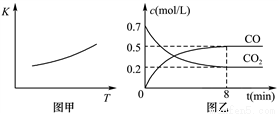
①反应ΔH__________0(填“<”或“>”)。
②下列措施中能使平衡时c(CO)/c(CO2)增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。计算该反应的平衡常数K=_______。
(3)已知:CO(g)+2H2(g)=CH3OH (g) ΔH=-116 kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1;
H2 (g)+1/2O2(g)=H2O(g) ΔH=-242 kJ·mol-1 ;
写出CH3OH燃烧生成CO2和水蒸气的热化学方程式_____________。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:实验题
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)反应生成的CH3COONa显_________f性,用离子方程式解释原因:____________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________。
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。
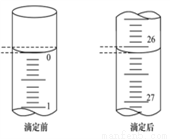
滴定次数 | 待食用白醋的体积/mL | 0.1000 mol/L NaOH溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | ______ | _______ | ________ |
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________。
查看答案和解析>>
科目: 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
学习化学过程中需要经常做实验。下列实验操作正确的是 ( )
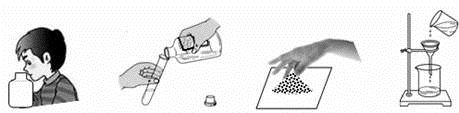
A. 闻气味 B. 倾倒液体 C. 取粉末 D. 过滤
查看答案和解析>>
科目: 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
①烧杯②坩埚③蒸发皿④试管⑤蒸馏烧瓶⑥锥形瓶⑦燃烧匙
A. ①⑤⑥ B. ③⑥⑦ C. ①⑤ D. ⑤⑥⑦
查看答案和解析>>
科目: 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com