
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
常温下,0.05 mol/L的Ba(OH)2溶液,pH为
A. 12.7 B. 13.0 C. 12.0 D. 13.7
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的 同时,有6个N-H键断裂
同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
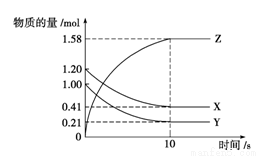
A. 反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1
C. 反应进行到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)≒Z(g)
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙错误的是
A. 负极反应式为Mg-2e-=Mg2+
B. 正极反应式为Ag+e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 电池放电时,外电路中,电子由负极向正极移动
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列说法中正确的是
A. 电解精炼铜时,将粗铜与电源的负极相连
B. 当反应物的总能量高于生成物的总能量时,该反应为吸热反应
C. FeCl3(aq)+3KSCN(aq) 3KCl(aq)+Fe(SCN)3(aq)体系中加入KCl固体,平衡向逆反应方向移动
3KCl(aq)+Fe(SCN)3(aq)体系中加入KCl固体,平衡向逆反应方向移动
D. 1807年,化学家戴维电解熔融氯化钾得到钾,直到现在,工业上依然用电解法制备金属钠、镁、铝等
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量( )。
A. 相同 B. 中和HCl的多 C. 中和CH3COOH的多 D. 无法比较
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
A. 该反应的平衡常数表达式为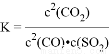
B. 若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C. 增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率
D. 若单位时间内生成2 mol CO2,同时消耗1 mol SO2,则说明反应达到平衡状态
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
关于下列装置的说法,正确的是
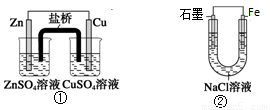
A. 装置①中,盐桥中的K+移向CuSO4溶液
B. 装置①中,Zn为负极,发生还原反应
C. 装置②中的Fe发生析氢腐蚀
D. 装置②中电子由Fe流向石墨,然后再经溶液流向Fe
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B. c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、Cl-、NO3-
C. 水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D. c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”。火药燃烧爆炸时发生的反应为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:①碳的燃烧热ΔH1=a kJ·mol-1
②S(s)+2K(s)=K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=c kJ·mol-1
则x为
A. 3a+b-c B. c-3a-b C. a-b-c D. c-a-b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com