
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
A. 服用铬含量超标的药用胶囊,会对人体健康造成危害
B. 血液透析是利用了胶体的性质
C. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D. 厨房中燃气泄漏,立即打开抽油烟机排气
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是( )
操作 | 现象 | 结论 | |
A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp: Mg(OH)2>Fe(OH)3 |
D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
某种药物合成中间体的结构简式为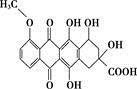 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
A. 属于芳香族化合物
B. 能发生消去反应和酯化反应
C. 能分别与金属Na、NaHCO3溶液反应
D. 1 mol该有机物与足量Na2CO3溶液反应,消耗5 mol Na2CO3
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
B. 标准状况下22.4 L H2 中含中子数为2NA
C. 1L 1mol/L醋酸溶液中离子总数为2NA
D. 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如下图所示。下列说法正确的是( )
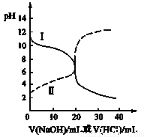
A. 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 曲线Ⅰ:滴加溶液到20 mL时: c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D. 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是 ( )
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
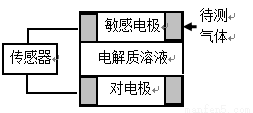
A. 上述气体检测时,敏感电极均作电池正极
B. 检测H2S气体时,对电极充入空气,该电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
C. 检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
D. 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:简答题
一氧化碳是一种用途相当广泛的化工基础原料。
⑴.利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g)该反应的ΔH_______0(选填“>”或“=”或“<”)。
Ni(CO)4(g)该反应的ΔH_______0(选填“>”或“=”或“<”)。
⑵.在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶.工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为___________。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:v(CH3OH)=__________;
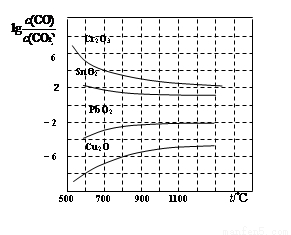
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃时,其中最易被还原的金属氧化物是____(填化学式),该反应的平衡常数数值(K)等于____________。
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:填空题
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
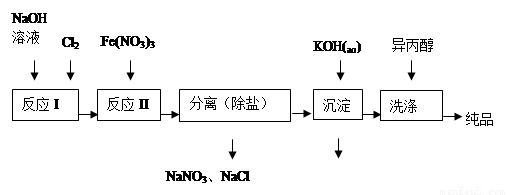
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目: 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:实验题
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
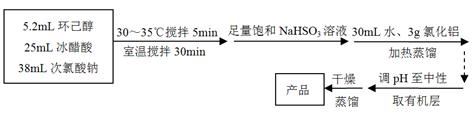
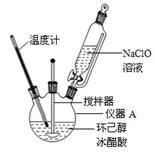
主反应: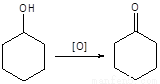
回答下列问题:
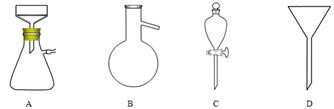
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com