
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A. Y、Z两元素的简单离子半径Y>Z
B. X与W可以形成W2X、W2X2两种化合物
C. X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致
D. Y、Z元素最高价氧化物对应的水化物酸性较强的为H2ZO4
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
甲醇燃料电池体积小、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某甲醇燃料电池的总反应式2CH4O + 3O2= 2CO2+ 4H2O,下图是该燃料电池的示意图。下列说法正确的是
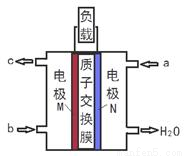
A. a是甲醇燃料、b是氧气
B. 当转移6mole-时,消耗33.6LO2
C. 负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+
D. 质子从N电极区穿过交换膜移向M电极区
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
25℃时,0.1molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是
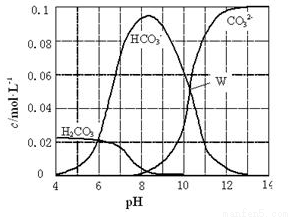
A. W点所示的溶液中:c (Na+)+c (H+)=2c(CO32- )+c (OH-)+c (Cl-)
B. pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl- )
C. pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
D. pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32- )>c (HCO3- )>c (H2CO3)
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
氰化钠是一种重要的化工原料。泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
(1)NaCN的电子式为_______。
(2)NaCN与双氧水反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,用H2O2处理1molNaCN时,反应中转移电子的物质的量为______mol。
(3)NaCN也能被酸性高锰酸钾溶液氧化,产生对大气无污染的气体和Mn2+,该反应的离子方程式是____________。
(4)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
I.实验室通过下图装置制备Na2S2O3。
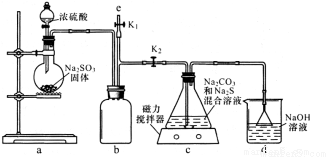
①装置中盛浓硫酸的仪器是_____,b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有____________。
③实验结束后,在e处最好连接盛NaOH溶液的容器,再________________(填具体操作),最防止拆除装置时污染空气。
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取15.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_______________。
(7)经计算处理后的废水中NaCN的浓度为________mg/L(保留两位小数),处理后的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJ•mol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJ•mol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJ•mol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJ•mol﹣1(用含a、b、c的代数式表示).
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
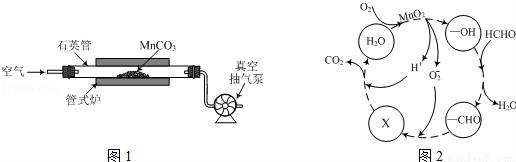
①2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
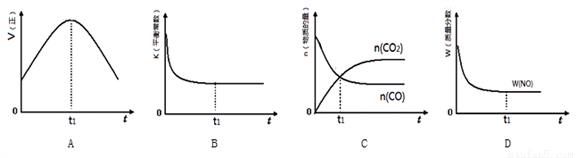
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如右图所示:
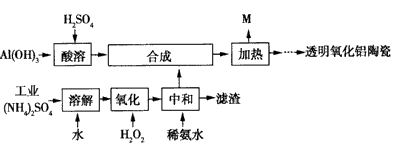
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为________________。
(2)当25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.75×105。(NH4)2SO4溶液呈酸性,其原因是(用力方程式解释):__________;该离子方程式的平衡常数K约为______(填具体数字)。
(3)如何检验中和液中的杂质离子已完全除尽_________。
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为__________。
(5)综上分析,流程图中M的主要成分的化学式为________,M可用一种物质吸收以实现循环利用,该物质的名称是_________。
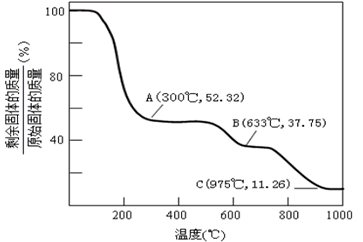
(6)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为_____________。
查看答案和解析>>
科目: 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
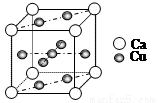
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目: 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列化学式中,只表示一种纯净物的是
A. C B. C4H8 C. C2H6O2 D. CH2Cl2
查看答案和解析>>
科目: 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列系统命名法正确的是
A. 2-甲基-4-乙基戊烷 B. 2,3-二乙基-1-戊烯
C. 2-甲基-3-丁炔 D. 对二甲苯
查看答案和解析>>
科目: 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实不能证明这一结论的是
A. 苯的一氯代物只有一种 B. 苯的二氯代物只有三种
C. 苯不能使酸性高锰酸钾溶液褪色 D. 苯分子中六个碳碳键键长完全相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com