
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
已知:H—Cl和H—I键能分别为431kJ/mol和297kJ/mol,下列性质比较正确且可用键能数据说明原因的是
A. 稳定性:HI>HCl B. 熔、沸点:HI>HCl
C. 同浓度的HI和HCl的酸性:HI>HCl D. 还原性:HI>HCl
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A. 溴水存在:Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 为提高合成氨反应的产率,可采取降低温度的措施
C. 反应CO(g)+NO2(g) CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
D. 可逆反应:2HI(g) H2(g)+I2(g)。达平衡后,缩小容器体积体系颜色变深
H2(g)+I2(g)。达平衡后,缩小容器体积体系颜色变深
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
密闭容器中有如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
A.m+n>p B.A的转化率降低
C.平衡向正反应方向移动 D.C的质量分数增加
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
向恒温恒容的密闭容器中充入amolX和bmolY,发生反应X(g)+3Y(g) 2Z(g)达到平衡时,测得X和Y的转化率分别为25%和37.5%。则a:b为
2Z(g)达到平衡时,测得X和Y的转化率分别为25%和37.5%。则a:b为
A. 1 3 B. 3
3 B. 3 1 C. 3
1 C. 3 2 D. 1
2 D. 1 2
2
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
对于可逆反应 2AB3(g) 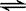 A2(g) + 3B2(g) △H>0,下列图像正确的是
A2(g) + 3B2(g) △H>0,下列图像正确的是
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
定量的稀硫酸与过量锌粉反应,为了减慢反应速率但又不影响生成氢气总量的措施是
A. 加入少量NaOH溶液 B. 加入少量的NaHSO4溶液
C. 加入少量的CH3COONa溶液 D. 加入少量的CuSO4溶液
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是
2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是
A. 均增加1mol B. 均减小1mol C. 均减半 D. 均加倍
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2。下列分析不正确的是
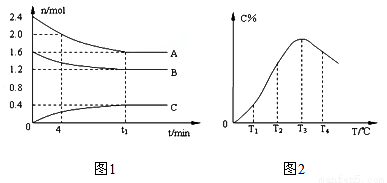
A. t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变
B. 该反应的平衡常数表达式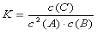
C. 由T1向T2变化时,V正> V逆
D. 此反应的正反应为放热反应
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:实验题
(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是_______.
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数)
②已知:CH3COOH(aq) CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”)
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为______________________________________
(4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________
(5)实验②和实验③两组实验的目的是______________________________
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:__________________(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目: 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:推断题
A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com