
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2 2Na2CO3+C。下列叙述错误的是
2Na2CO3+C。下列叙述错误的是
A. 放电时,Na+由负极向正极移动
B. 充电时,阴极反应式为Na++ e—= Na
C. 电解质溶液可选NaClO4水溶液
D. 电池放电时把二氧化碳变废为宝,有重要的研发意义
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
下列除杂方法错误的是
括号内为杂质 | 实验操作或方法 | |
A. | NO2(NO) | 通入O2 |
B | CuSO4溶液[Fe2(SO4)3] | 加入足量CuO,过滤 |
C | 溴苯(溴) | 加入NaOH溶液,分液 |
D | MnO2(I2) | 加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
某水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
①第一份加足量NaOH溶液加热后,收集到气体0.05 mol;
②第二份加足量BaCl2溶液后,得干燥沉淀4.3 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。下列说法正确的是
A. K+一定存在
B. 溶液中c(Cl-)可能为0.2 mol/L
C. Cl-可能存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:实验题
间溴苯甲醛(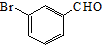 ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验室制备步骤如下:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。(实验装置见下图)
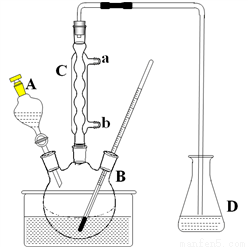
(1)仪器A的名称为___________________,1,2-二氯乙烷的电子式为__________;
(2)实验装置中冷凝管的主要作用是________,进水口为____(填“a”或“b”);
(3)步骤1反应方程式为____________________;为吸收尾气锥形瓶中的溶液应为________,反应的离子方程式为________________;
(4)水浴加热的优点是__________________________;
(5)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式);
(6)步骤4中采用减压蒸馏技术,是为了防止_______________。
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,也是一种优质的燃料。
Ⅰ.甲醇脱氢制取甲醛的原理为CH3OH(g)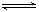 HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
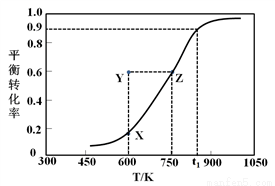
(1)下列选项中,能说明该反应达到平衡状态的是__________;
a.v(CH3OH) =v(HCHO) b.H2的体积分数不再变化
c.甲醛的质量分数不再改变 d.混合气体密度不变
(2)在t1时,该反应的平衡常数为K=________________,此温度下,从反应开始到平衡所经过的时间为5 s,则v(HCHO)为_______mol/(L·min)。向此容器中再通入1.1 mol CH3OH和1.1 mol H2,则平衡向_________(填“正反应”或“逆反应”)方向移动;
(3)600 K时,Y点甲醇的v(正)_______v(逆) (填“>”、“<”或“=”),理由是_____________________;
Ⅱ.已知:CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;
2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;
(4)则在铜作催化剂时:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH3=______kJ/mol(用含a,b的代数式表示);
Ⅲ.如图所示是以NaOH溶液为电解质溶液的甲醇燃料电池:
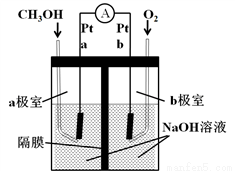
(5)a极电极反应式为__________________________,若隔膜为阴离子交换膜,则电池工作一段后,电池负极区溶液中n(OH-)_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:简答题
Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
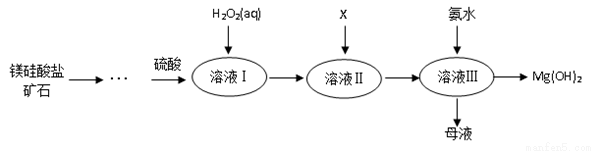
已知:
①溶液Ⅰ中除含Mg2+、SO42?外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
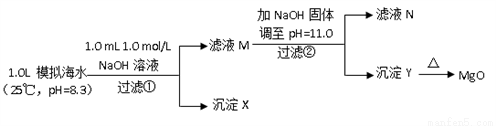
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaO H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:简答题
铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价电子层排布式是__________________;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于_______晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为_____,空间构型为_______;CCl4的中心原子杂化类型为________,其等电子体为___________(写出一个离子形式);
(3)某镍配合物结构如下图所示。
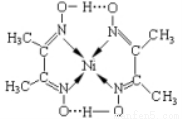
分子内含有的作用力有_________________(填序号),其中属于第二周期元素的第一电离能由大到小的顺序是_____________(填元素符号);
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________________;
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0.1 mol CoCl3·4NH3的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全共消耗50 mL溶液,则该配合物的化学式为________________;
(6)下图是Fe的晶体一种堆积方式,若晶胞的边长为a pm,则晶体的密度为_______g·cm-3(用含a和NA的表达式表示)。
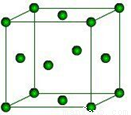
查看答案和解析>>
科目: 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:推断题
有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
 已知:
已知:
I.烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2,35%-40%的F的水溶液被称为福尔马林。
II.
(1)A的名称为__________(系统命名法),B的结构简式为_______________,F的分子式为_____________;
(2)B→C的反应条件是______________,G的官能团名称是_____________;
(3)D与银氨溶液反应的方程式_____________________;
(4)E与H反应生成M的方程式___________________;
(5)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为________________。
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
下列各原子序数中,其相应元素原子能形成XY2共价化合物的是
A. 3与8 B. 1与16 C. 12与17 D. 6与8
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
下列含有共价键的离子化合物的是
A.Na2OB.CaCl2C.NH4ClD.H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com