
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法错误的是( )
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料
C. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
D. 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷 B. 乙烯、苯都能发生加成反应
C. 乙烯、聚氯乙烯分子中都含有碳碳双键 D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
短周期主族元素甲、乙、丙、丁、戊的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,在中学常见的酸中戊的最髙价氧化物对应的水化物的酸性最强。下列叙述错误的是( )
A. 氧元素与甲、乙、丙形成的二元化合物均只有两种
B. 简单离子半径:戊 >乙>丙>丁
C. 甲、乙、戊三种元素可形成含有共价键的离子化合物
D. 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,1.12L CCl4含有的共价键数为0.2NA
B. 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C. 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA
D. 常温下,0.1mol·L-1溶液中阴离子总数大于0.1NA
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
分子式为C7H6Cl2的芳香族化合物共有(不含立体异构体)( )
A. 6种 B. 9种 C. 10 种 D. 12 种
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )

A. A为正极
B. 电池工作时H+由A极向B极迁移
C. 从b 口通入四氧化二氮气体且在B极发生氧化反应
D. A极发生的电极反应式:C2H8N2+4H2O+16e-=2CO2+N2+16H+
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变 成血红色 | Fe2+既有氧化性 又有还原性 |
B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
C | 室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:简答题
利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4 • H2O 的实验流程如下:
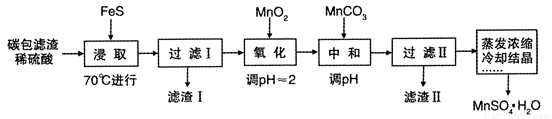
已知:25℃时,几种硫化物的溶度积常数如下:
物质 | FeS | MnS | HgS |
溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 2.7 | 7.6 | 8.3 |
完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有______________。
(2)在加热条件下“浸取”,其原因是__________________;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为__________________________。
(3)滤渣I的成分为MnO2、C和____________(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/C(Fe2+)= ____________(填数值)。
(4)“氧化”时的离子方程式为____________;氧化时可用H2O2代替MnO2,H2O2的电子式为_______。
(5)中和时,应该调节溶液pH的范围到____________。
查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:简答题
甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ • mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
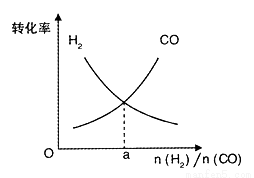
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。

查看答案和解析>>
科目: 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:实验题
直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
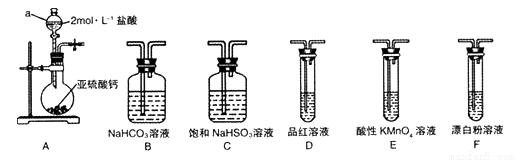
(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com