
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )

A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3>C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液 | 产生白色浑浊 | Ksp(Ag2SO4)< Ksp(Ag2CO3) |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大。四种元素的原子最外层电子数总和为19, W、X、Y的简单离子的电子层结构相同,W与X不同周期,W与Z同主族,Y的最外层电子数等于其所在周期数。下列说法正确的是( )
A. 单质的沸点:W<X B. 原子半径:W>Y ;
C. 金属性:X<Y D. 最简单氢化物的还原性: W >Z
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
下列相关离子方程式书写正确的是( )
A. NH4HSO3溶液与少量的氢氧化钠溶液混合加热:NH4++OH-=NH3↑+H2O
B. 向NaHCO3溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+ CO32-
C. 等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )
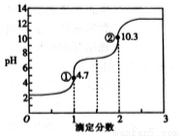
A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处: c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:实验题
亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。
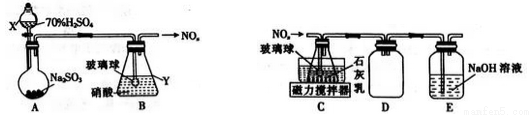
①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:填空题
MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ • mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ • mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ • mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。
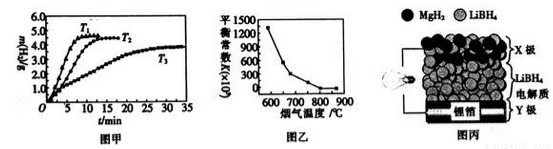
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g) 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:实验题
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、A1,少量Cr、FeS等)来制备,其工艺流程如下:
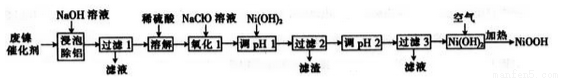
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为________________。
(2)“溶解”时放出的气体为_________(填化学式)。
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为______________。
(4)己知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为__________;过滤2所得滤渣的成分为___________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式______________。
(6)若加热不充分,则制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·y Ni(OH)2。现称取8.29g xNiOOH·y Ni(OH)2样品溶于稀硫酸,搅拌至溶液澄清,定容至200mL,从中移取20.00 mL,用0.010mol·L-1的KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4 标准溶液 20.00 mL。已知 5Ni2++MnO4-+8H+=5Ni3++Mn2++4H2O,则x=_________,y=_________。
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:填空题
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。
回答下列问題:
(1)基态磷原子的核外电子排布式为____________。
(2)P4S3可用于制造火柴,其分子结构如图1所示。
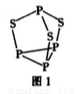
①第一电离能:磷_______硫;电负性;磷_________硫(填“ > ”成“<”)。
②P4S3分子中硫原子的杂化轨道类型为___________。
③每个P4S3分子中含孤电子对的数目为___________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图所示,沸点:PH3<NH3其原因是_________;沸点:PH3<AsH3<SbH3,其原因是_____________。
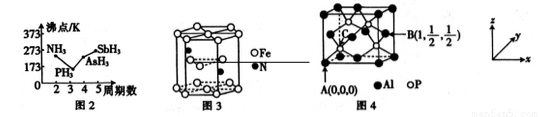
②某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为___________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________。
②图中A点和B点的原子坐标参数如图所示,则C点的原子坐标参数为_____________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为________cm。
查看答案和解析>>
科目: 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:推断题
第四届中国工业大奖于2016年12月11日在北京颁奖,获奖项目之一为国家级一类抗癌新药——盐酸埃克替尼的研发。它的关键中间体G的一种合成路线如下:
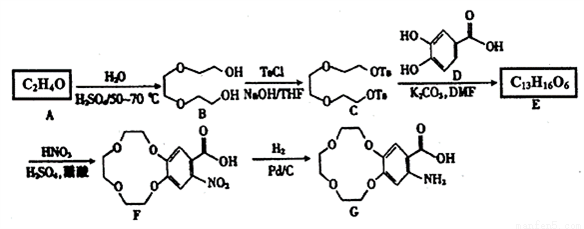
己知:①A分子中只有一种化学环境的氢;
②TsCl为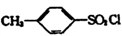 。
。
(1)A的名称为______________。
(2)G中所含官能团的名称是______________; E的结构简式为___________________。
(3)由B生成C的反应类型是_____________,由F生成G的反应类型是______________。
(4)PEO是由A在烃基铝催化下加聚而成的线型髙分子,该加聚反应的化学方程式为_______________。
(5)三取代芳香族化合物W是D的同分异构体。W既能发生银镜反应和水解反应,又能与FeCl3溶液发生显色反应。1molW最多可与4molNaOH反应,W的核磁共振氢谱只有4组峰。W的结构简式为_________________。
(6)参照上述合成路线, 以邻硝基甲苯(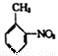 )和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(
)和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(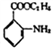 )的合成路线。_________________
)的合成路线。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com