
科目: 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:简答题
布洛芬(C13H18O2)具有抗炎、镇痛、解热作用,其合成路线如下:
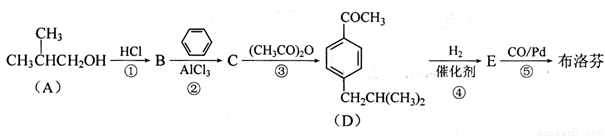
已知: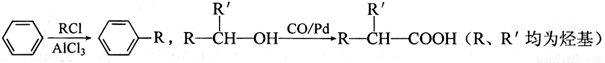
请回答以下问题:
(1)反应①〜⑤中,属于取代反应的有______ (填编号);
(2)E中官能团的名称为______;
(3)布洛芬的结构简式为______。
(4)写出反应③的化学方程式:____________。
(5)比布洛芬少5个碳原子的同系物X有多种同分异构体,写出同时满足下列条件的 所有
X的同分异构体结构简式:_________________;
a.属于芳香族酯类化合物 b.核磁共振氢谱呈现4种峰,且峰面积之比为3:2:2:1
写出其中一种能发生银镜反应的物质在NaOH溶液中水解的反应方程式:______。
查看答案和解析>>
科目: 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:实验题
红矾钠(重铬酸钠: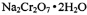 )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
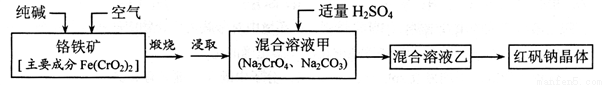
请回答下列问题:
(1)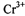 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________ 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被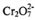 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含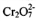 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法正确的是
A. 石油分馏的目的是获得乙烯、丙烯和丁二烯
B. 减少SO2的排放,可以从根本上消除雾霾
C. 食品工业利用液态二氧化碳代替有机溶剂,能避免有机溶剂污染食品
D. 蔬菜表面洒少许福尔马林,可保鲜和消毒
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍。下列有关这四种元素的相关叙述正确的是( )
A. R的氢化物比Y的氢化物的沸点更高 B. X与Z组成的化合物溶于水呈碱性
C. 只有Y元素存在同素异形体 D. X、Y、Z、R形成简单离子的半径依次增大
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L空气中O2、N2分子总数目为NA
B. 0.1 mol羟基中所含电子数目为NA
C. 28 g乙烯、丙烯混合气体中所含原子数为6NA
D. 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述错误的是
下列叙述错误的是
A. 放电时正极附近溶液的碱性增强
B. 充电时锌极与外电源正极相连
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被还原
D. 充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- FeO42- + 4 H2O
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操 作 | 现 象 | 结 论 | |
A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
C | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是

A. a、b、c、d四个点中,水的电离程度最大的是d
B. a点溶液中:c(NH3·H2O)+c(H+)=c(OH—)
C. b点溶液中:c(Na+)+c(NH4+)=2c(SO42—)
D. c点溶液中:c(Na+)= c(SO42—) +c(NH4+)+ c(NH3·H2O)
查看答案和解析>>
科目: 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:简答题
工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+  Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O  [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:

① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com