
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
用石墨作电极完全电解含1 mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是
选项 | X溶液 | 物质Y |
A | CuCl2 | 1 mol Cu(OH)2 |
B | KOH | 1 mol KOH |
C | Na2SO4 | 1 mol H2SO4 |
D | AgNO3 | 0.5 mol Ag2O |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2的 |
B | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
C | 测定中和热时,使用碎泡沫起隔热保温的作用,用普通玻璃棒进行搅拌使酸和碱充分反应,准确读取实验时的最高温度并且取2~3次的实验平均值等,以达到良好的实验效果 | 用简易量热计 测定反应热来 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
为了除去MgCl2酸性溶液中的Fe3+,可在加热、搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是( )
A.NH3H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是( )
A、c(OH-)> c(H+) B、c(CH3COOH)+c(CH3COO-)=0.2mol/L
C、c(CH3COOH)>c(CH3COO-) D、c(CH3COO-)+c(OH-)=0.2mol/L
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3,按c(CO32-)由小到大排列顺序正确的是( )
A、⑤<④<③<②<① B、③<⑤<②<④<①
C、③<②<⑤<④<① D、③<⑤<④<②<①
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
室温下,下列溶液中粒子浓度大小关系正确的是
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)  Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A、n (Ca2+)增大 B、c(Ca2+)不变
C、c(OH-)增大 D、n(OH-)不变
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全反应生成氮气和1 mol气态水过程中的能量变化图。
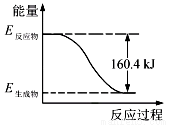
(1)该反应属于________(填“吸热”或“放热”)反应。
(2)写出该火箭推进器中相关反应的热化学方程式:__________________。
(3)若该火箭推进器中H2O2有12 mol共价键发生断裂,则反应释放出的热量______kJ。
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________。
(2)该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L?1。
(4)上述(3)达到平衡后N2O4的转化率为_______,混合气体的平均摩尔质量为____________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目: 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O  H3O+ + OH—,则液态NH3电离的方程式是_______________________
H3O+ + OH—,则液态NH3电离的方程式是_______________________
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______,在此温度下,将pH=a的H2SO4溶液Va L与pH=b的NaOH溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=_________
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①常温时,甲酸的电离平衡常数Ka=1.70×10-4。甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因 ____________,0.1mol/L的甲酸钠溶液pH约为_______(已知:lg17 ≈1.23, 计算结果保留一位小数)
②向20ml 0.1mol/L的甲酸钠溶液中小心滴加10ml 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序_______________
(4)室温时,M(OH)2(s) M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L?1时,溶液的pH等于_________
M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L?1时,溶液的pH等于_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com