
科目: 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:计算题
某有机物A与氢气的相对密度是30,取有机物A 6.0g完全燃烧后,生成0.2molCO2和0.2molH2O。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应。
(1)计算该有机物的分子式。
(2)根据该有机物的性质,写出其结构简式。
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述不正确的是
A. PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
B. 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:灼烧→浸泡→过滤→萃取→粗碘提纯
C. 海水淡化的方法有蒸馏法、电渗析法等
D. 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不同
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 有机物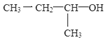 的名称为2-丁醇
的名称为2-丁醇
B. 蛋白质、淀粉、纤维素都是高分子化合物
C. 合成有机物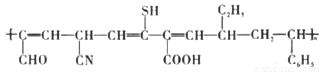 使用的单体有3种
使用的单体有3种
D. 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-)
C. a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D. 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
短周期A、B、C、D、E五种主族元素,原子序数依次增大,B、C、E最外层电子数之和为11,A原子最外层电子数是次外层电子数的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解氧化物的方法获得D的单质,E单质是制备太阳能电池的重要材料。下列说法正确的是
A. 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多
B. C与D的最高价氧化物对应的水化物的碱性相比,后者更强
C. 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 简单离子半径:B<C
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
按如图所示装置进行下列不同的操作,其中不正确的是

A. 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2
B. 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH-
C. 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升
D. 只闭合K2,U型管左、右两端液面均下降
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l②c(HNO3)=0.5mol·L-1③m=8.0④m=7.2其中正确的是( )
A.①④ B.①③ C.②④ D.②③
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:简答题
热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)  H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | |||
H2O | CO | H2 | CO | ||||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 | |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 | |
3 | 900 | a | b | c | d | t | |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。
查看答案和解析>>
科目: 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:简答题
工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
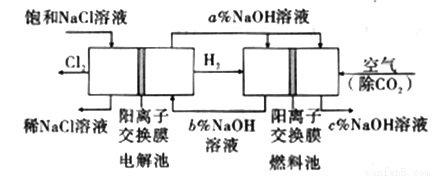
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
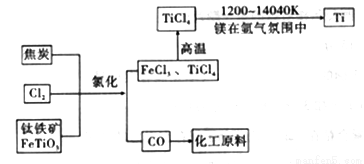
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com