
科目: 来源: 题型:
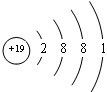

查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 900 | 1757 | 14849 | 21007 |
| R | 2081 | 3952 | 6122 | 9370 |
| T | 496 | 4562 | 6912 | 9544 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目: 来源: 题型:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com