
科目: 来源: 题型:
【题目】制备溴苯的实验装置如右图所示,请回答下列问题:
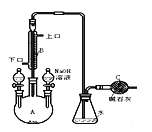
(1)反应开始前已向仪器A中加入的固体药品是铁粉,则装在左侧分液漏斗中的液体药品是 。
(2)写出实验室制溴苯的化学方程式 。
(3)该反应装置中冷凝管B有上、下两个口,冷却水应从 口进入(填“上”或“下”)。
(4)右侧分液漏斗中的物质在 加入A中(填“反应前”、“反应中”或“反应后”),用离子方程式表示其作用是 。
(5)C中碱石灰的作用是 。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3 ; Br2+FeBr3=FeBr4-+Br+ (不稳定) ;
![]() +Br+→[
+Br+→[![]() ] ; [
] ; [![]() ]+FeBr4-→
]+FeBr4-→![]() +HBr+FeBr3 。
+HBr+FeBr3 。
由上述反应可推知:![]() +Br2 →
+Br2 → ![]() +HBr 中的催化剂为 。(填字母)
+HBr 中的催化剂为 。(填字母)
A. Br2 B.FeBr3 C.Br+ D.FeBr4-
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下: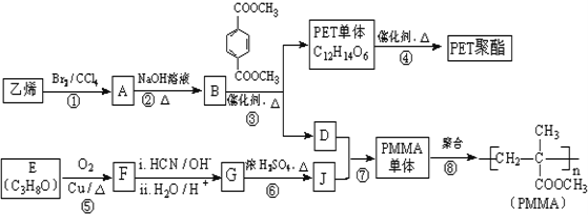
已知:
Ⅰ.RCOOR′+R″18OH ![]() RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ.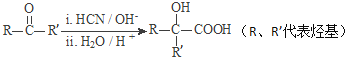
(1)①的反应类型是_____________.
(2)②的化学方程式为_____________.
(3)PMMA单体的官能团名称是_____________、_____________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_____________。
(5)G的结构简式为_____________。
(6)下列说法正确的是_____________(填字母序号).
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1mol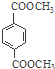 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH
(7)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n或C10n+2H8n+6O4n+2)并生成B的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用
(1)P原子价电子排布图为_________。
(2)四(三苯基膦)钯分子结构如下图1:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_________;判断该物质在水中溶解度并加以解释_________,该物质可用于图2所示物质A的合成:
物质A中碳原子杂化轨道类型为 _________;一个A分子中手性碳原子数目为 _________。
(3)在图3中表示出四(三苯基膦)钯分子中配位键:
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为_________;正四面体形阳离子中键角小于PCl3的键角原因为_________;该晶体的晶胞如右图4所示,立方体的晶胞边长为apm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3.
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰是一种银白色的脆性金属,强度不如铁,但把锰加到钢铁中,竟然能使钢铁的强度提高4~8倍,而且还提高了钢的耐磨性,所以锰钢在工农业生产及国防建设中有着广泛的用途。
用阴离子膜电解法的新技术从含有MnCO3、MnO2、FeCO3、SiO2、Al2O3等成分的锰矿石中提取金属锰,其工艺流程如下:
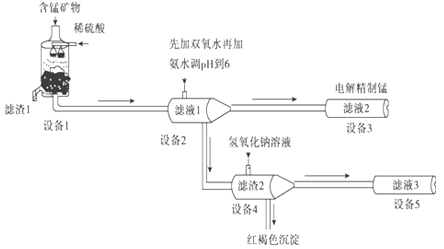
已知FeCO3、MnCO3难溶于水.
(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2.则滤渣1的主要成分是_________(填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是_________。
(3)设备2中加足量双氧水的作用是_________。设计实验方案检验滤液2中是否存在Fe2+:_________。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解.用化学平衡移动原理解释原因:_________。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:
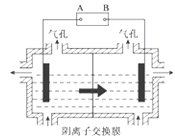
①电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的_________极。实际生产中,阳极以稀硫酸为电解液,其电极反应式为_________。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用氟磷灰石[(Ca5(PO4)3F)]生产磷铵[(NH4)3PO4]并制取硫酸、联产水泥。其工艺流程如下图所示:
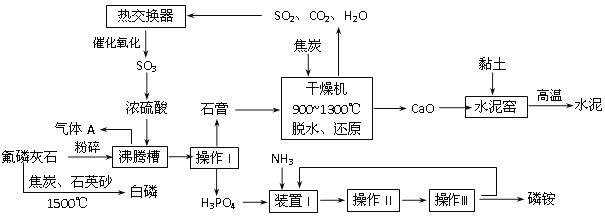
(1)操作I的名称________________;在实验室中操作II包括___________、____________。
(2)沸腾槽的材质是_______________(从“玻璃”、“钢铁”、“附有聚偏氟乙烯防腐层的石墨”中选择),选择的理由是__________________________________________________
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:_________________________________________。
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为____________。
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g) ![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
从化学反应原理的角度说明催化氧化时使用热交换器的原因__________________。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。
编号 | 试剂组 | 结论 |
① | NaOH溶液、酚酞试液 | |
② | Na2CO3溶液、酚酞试液 | |
③ | 碘水、淀粉溶液 | |
④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
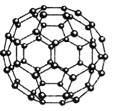
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为 。已知:
。已知:
Ⅰ.![]()
![]()
Ⅱ.![]()
双安妥明的合成路线如下:

已知:C的分子式为C4H8,且支链有一个甲基;Ⅰ能发生银镜反应且1molI能与2mol氢气发生加成反应;K的结构具有对称性.试回答下列问题:
①写出结构简式:A_________,J _________,C化学名称_________。
②反应(2)的条件是_________,反应(3)的类型是_________。
③写出反应(4)的化学方程式_________。
④与F互为同分异构体,且属于酯类的有机物,写出其中能发生银镜反应的有机物的结构简式_________、_________。
⑤与丙烯酸互为同系物,且相对分子质量为100,其结构共有_________种(不考虑立体异构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是

A. 有O2放电的a极为电池的负极
B. O2-移向电池的正极
C. b极对应的电极反应为2H2-4e-+2O2-=2H2O
D. a极对应的电极反应为O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com