
科目: 来源: 题型:
【题目】可由N物质通过以下路线合成天然橡胶和香料柑青酸甲酯衍生物F。

已知:

(1)用系统命名法对N命名________.
(2)①试剂a的名称是________。②C→D中反应i的反应类型是________。
(3)E的结构简式是_____________。
(4)关于试剂b的下列说法不正确是________(填字母序号)。
a. 存在顺反异构体 b. 难溶于水c. 能发生取代、加成和氧化反应 d. 不能与NaOH溶液发生反应
(5)写出A生成B的反应方程式_________。
(6)分子中含有![]() 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
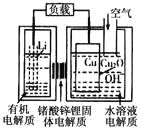
A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,正极的电极反应式为O2+2H2O+4e-==4OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物K在化工和医药方面有重要的应用,其合成路线如下:

已知信息:
①C能发生银镜反应,E的相对分子质量比D大4,G的苯环上的一溴代物有两种
②![]()
![]()
![]()
③2RCH2CHO![]()
![]()
请回答下列问题:
(1)F的名称是__________,H含有的官能团是__________。
(2)A→B的反应类型是__________,F→G的反应类型是__________。
(3)C与银氨溶液反应的化学方程式是__________。
(4)K的结构简式是__________。
(5)符合下列要求的C8H10O的同分异构体有__________种.
①芳香族化合物②与Na反应并产生H2③遇FeCl3溶液呈紫色,
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是__________(写出其中一种结构简式)
(6)参照已知信息和成路线,设计一条由CH2=CH2为原料合成CH3CH2CH2CH2OH的路线(注明反应条件):__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
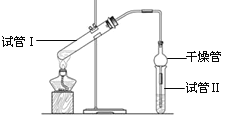
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________gcm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目: 来源: 题型:
【题目】著名丹麦物理学家尼·玻尔(N·Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。纳粹分子对这种溶液“愚笨”得视而不见、毫无所知。战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
A.王水能溶解黄金,但不能溶解白金
B.HAuCl4具有很强的氧化性
C.盐酸有很强的还原性
D.浓盐酸和浓硝酸按照体积比1:3能配成王水
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F分别代表原子序数依次增大的短周期元素。A和D属同族元素;B和F位于第VIIA族;A和B可形成化合物AB4;C基态原子的s轨道和p轨道的电子总数相等;E的一种单质在空气中能够自燃。 请回答下列问题:
(1)D基态原子的电子排布式是_____________________。
(2)利用价层电子对互斥理论判断EF3的立体构型是______。
(3)A所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);B和F的氢化物中沸点较高的是_____(填化学式);C、D、F的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作E4中毒的解毒剂,反应可生成E的最高价含氧酸和铜,该反应的化学方程式是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:![]()
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
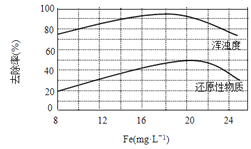
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:

(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶_______∶________∶_________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,H2SO4溶液的浓度____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com