
科目: 来源: 题型:
【题目】下图是中学化学中常见有机物转化关系(部分相关物质和反应条件已略去)

已知:Ⅰ. C的相对分子质量为60,且分子中碳元素的质量分数为40% 。
Ⅱ.B、 C、D分子含碳原子个数相同;E为高分子化合物。
回答下列问题:
(1)B中含有的官能团名称为 。
(2)E中链节为 。
(3)写出反应①的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,D原子核外电子有8种不同的运动状态, E是用途最广泛的金属,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)E元素在周期表中的位置 ;F+的电子排布式为 。
(2)化合物BD(CA2)2中,B原子的杂化方式为 ,1mol该分子中σ键数目为 个,该物质易溶于水的主要原因是 _ _____________。
(3)ACD3中阴离子CD3-的空间构型为 ,ACD3酸性比ACD2强,原因是___________。
(4)根据等电子体原理,BD分子的电子式为 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于 晶体。
(5)3g B2A6在足量氧气中燃烧并恢复到室温,放出Q kJ热量,则表示B2A6燃烧热的热化学方程式为
______ _ _____________。
(6)将F单质粉末加入到CA3的浓溶液中,并通入D2,充分反应后溶液呈深蓝色,写出该反应的化学方程式 _ _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、单质硅由于其成熟的生产工艺, 丰富的生产原料及优异的性能被广泛用于电子行业及太阳能电池的生产等,在二氧化碳氛围中通过利用金属钠来还原二氧化硅可在较低的温度条件下得到硅,同时生成一种盐X,这相比起现有的生产工艺具有节约能耗的优势。
(1)写出上述制备硅的化学反应方程式_____________________。
(2)二氧化硅与二氧化碳物理性质差别很大,原因是__________________________。
(3)盐X的溶液能与Al2(SO4)3溶液反应生成一种白色沉淀和气体。写出此反应的离子反应方程式________。
Ⅱ、某盐A有3种元素组成,易溶于水。将A加热,生成既不助燃,也不使湿润的红色或蓝色石蕊试纸变色的气体B和H2O。将A溶于水,进行下列实验:①酸性条件下与H2S作用生成淡黄色沉淀C,同时放出无色气体D,D在空气中转变为红棕色气体E;②当通入足量Cl2时,无明显现象,但将所得溶液浓缩后即可得到无色晶体盐F。请回答下列问题:
(1)写出A的化学式:_____________; B的电子式:_______________。
(2)写出上述实验①、②所发生的离子反应方程式:①________________________________;②__________________________________。
(3)D、E对环境有危害,可用NaOH溶液来吸收等物质的量的D、E混合气体,写出其化学反应方程式___________________。
(4)判断盐F的可能成份______________;设计实验方案确定F的成份__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【加试题】硼与铝为同族元素。据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸。硼镁矿主要成分为Mg2B2O5.H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下:
![]()

请回答:
(1)步骤①中实验室需要把硼镁矿放在 仪器中焙烧(填实验仪器)。
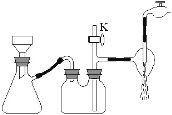
(2)步骤③中采用减压过滤,该小组同学所用的装置如右图所示,若实验过程中发现倒吸现象,应采取最简单的实验操作是 ;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使得到的硼酸晶体有较大颗粒的是 。
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3溶液
C.采用较稀的NH4H2BO3溶液
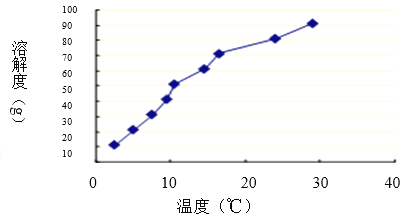
(3)硼酸是极弱的一元弱酸,用离子方程式表示硼酸溶液显酸性的原因 ;硼酸溶解度如下图所示,从操作③中获得H3BO3晶体需要洗涤、干燥,洗涤过程中需要用 (填“冷水”或“热水”),你的理由是 ;
(4)测定硼酸晶体纯度的试验方法是,取0.5000g样品与锥形瓶中,滴加甘油,微热使样品溶解,迅速冷却至室温,滴加指示剂,用NaOH标准溶液滴定至15.80ml时到达终点。已知:每1.00mlNaOH滴定液相当于30.92mg的H3BO3,则该样品中H3BO3的质量分数为 ;
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳整理是科学学习的重要方法之一。氧族元素的部分性质归纳整理如下:
|
|
|
|
|
单质熔点/℃ | -218,4 | 113 | ? | 450 |
单质沸点/℃ | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:________________;
(2)碲(Te)可能的化合价有:___________________;
(3)硒(Se)的原子半径可能在_______________________之间。
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐_________(增强、减弱)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)![]() H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
A.等于15s B.等于10 s C.大于10s D.小于10 s
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。
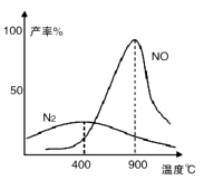
温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】electroFenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2==Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。
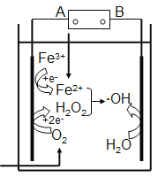
下列说法不正确的是( )
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O -e- == ·OH + H+
D.消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目: 来源: 题型:
【题目】普鲁卡因M [结构简式为![]() ]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
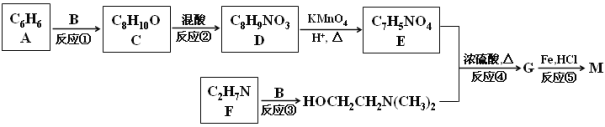
已知:Ⅰ.B和乙醛互为同分异构体,![]() 的结构不稳定;
的结构不稳定;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
请回答下列问题:
(1)E所含官能团的名称是 ;B的结构简式的 。
(2)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是 。
(3)下列说法正确的是 。
A.M分子中含有碱性基团氨基,能与盐酸发生反应,临床上常用M的盐酸盐作麻醉剂
B.题中的“混酸”是将浓硫酸缓慢加入浓硝酸中并不断搅拌而得的混合物
C.①、③属于加反应;②、④、⑤属于取代反应
D.反应①原子利用率达100%,生成的C通过加聚反应可直接生成高聚物聚苯乙烯,是一种绿色环保的工艺流程
(4)写出反应④的化学方程式 。
(5)写出一种同时满足下列条件的D的同分异构体的结构简式 。
①能与碳酸氢钠溶液反应 ②含有—NH2 ③苯环上有2种不同环境的氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;该仪器使用前须检漏,检验方法为 。
(2)反萃取时加入20%的NaOH溶液,其离子方程式为 。
(3)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(4)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出;与传统工艺相比,萃取法的优点是 。
(5)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg·L―1,实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5mL 0.02mol·L―1溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol·L―1 KI溶液,振荡。
步骤4: ,再用0.01mol·L―1 Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)。
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg·L―1。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com