
科目: 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A _____ C _____ D ____ _ E _____ 。
(2)用电子式表示B和F形成化合物的过程:_____ 。
(3)D在周期表中的位置_____ ,E的氢化物中化学键类型是 ,比较D与E氢化物的稳定性 (用化学式填空);
(4)写出C、F两种元素最高价氧化物的水化物相互反应的化学方程式: ___ _____
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,容积为2L的定容密闭容器中,充入3molA、ymolB,发生反应:3A(g)+2B(g)![]() 2C(g)+xD(g)。2min后达到平衡,测得从反应开始到平衡时C的速率为0.3mol·L-1·min-1.下列推断的结论正确的是
2C(g)+xD(g)。2min后达到平衡,测得从反应开始到平衡时C的速率为0.3mol·L-1·min-1.下列推断的结论正确的是
A.y![]() 1.2
1.2
B.增大反应体系的压强,反应速率不一定增大
C.v正(A)>v逆(C),不可能为平衡状态
D.混合气体的密度不再变化,一定为平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式___________________;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K的值为_____;
②三个容器中的反应分别达平衡时各组数据关系正确的是_____(填序号)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。

查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液
③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸
⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
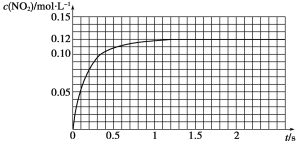
(1)反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
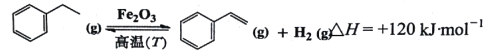
(1)升高反应温度,其转化率________,反应速率________(填“增大”、“减小”或“不变”)。
(2)等温、等压下,通入惰性气体(如水蒸气)能提高反应的转化率,其原因是________。
(3)通入水蒸气可延续催化剂Fe2O3被还原而失活,其原因是________(用化学平衡原理解释)。
(4)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。回答下列问题:
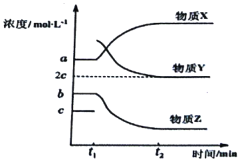
①物质X为__________,判断理由是__________;
②t2时刻,苯乙烯的浓度为______molL-1;
③t1-t2时间段内,乙苯的反应速率为_______molL-1min-1;
(5)温度T下,已知H2和苯乙烯的燃烧热△H分别为-290kJmol-1和-4400kJmol-1,则乙苯的燃烧热为△H_______kJmol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是:Z________,T________
(2)Y原子的结构示意图为____________________,U2X的电子式
(3)YX2和U2Y反应的化学方程式为____________________________,其中氧化剂是____________,被氧化的元素是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
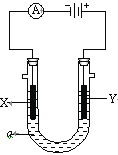
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)十2B(g)===C(g)的反应过程中能最变化如下图所示。下列相关说法正确的是

A.曲线b表示使用催化剂后的能量变化
B.正反应活化能大于逆反应活化能
C.由图可知该反应的焓变△H=+91 kJmol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如右图所示:

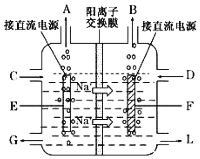
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO![]() 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 ,F电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为 (保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com