
科目: 来源: 题型:
【题目】硫化锌 (ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
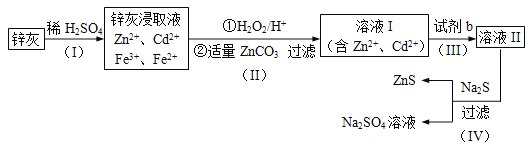
(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为________;
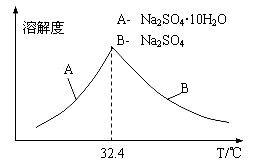
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修2 化学与技术】
Ⅰ.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
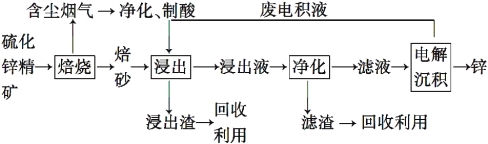
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
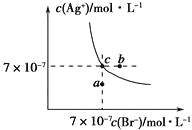
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJmol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJmol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJmol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
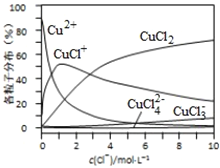
①当c(Cl-)=9molL-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1molL-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3L-3)
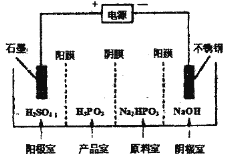
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是
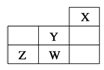
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. W的非金属性比Z的弱
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目: 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,其中只有C为金属元素。A和C同主族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是__________,非金属性最强的是__________(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示);
(3)D在周期表的位置为__________
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为__________,该化合物溶于水,显__________性(填“酸”、“碱”、“中”)原因是__________(用离子方程式表示);
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室用电石和水反应制取乙炔
①反应的化学方程式为__________。
②下图是反应装置,其中正确的是__________。
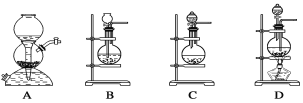
③为了减缓反应速率,通常用__________代替水,该反应是__________反应(“放热”或者“吸热”)
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为__________。
(2)实验室通常用浓硫酸和乙醇混合加热制取乙烯
①混合浓硫酸和乙醇的操作方法是__________。
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、__________和__________;
③反应生成的乙烯中,含有多种CO2、CO2、水等多种杂质,写出浓硫酸直接将乙醇氧化生成CO2的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
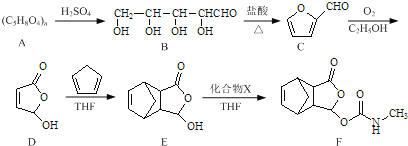
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=—99kJ.mol-1,
CH3OH(g)△H1=—99kJ.mol-1,
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式__________。
(2)由上述数据计算出△H3=kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是__________(填序号)
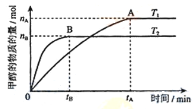
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tAmol/(L·min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;该温度条件下,反应平衡常数为__________(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com