
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气和MnCl2等。

(1)甲同学实验中选用的物质化学式为:A___________,B__________,C___________;
(2)C处反应的离子方程式为________________________ ;
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式______________________ ;
(4)A处反应的离子方程式为_________________________;
(5)B处的实验现象为 ___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.锌与稀硫酸的反应既是氧化还原反应,又是 反应(填“放热”或“吸热”,实验室可将该反应设计成原电池,应采用 作为负极材料,正极的电极反应式为 ,若有1mol电子流过导线,理论上正极产生的气体在标准状况下的体积是 L。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
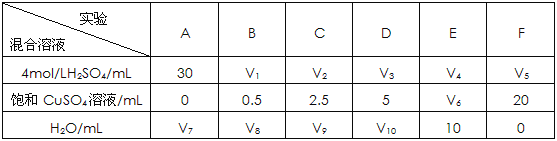
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目: 来源: 题型:
【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤____________⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有___________对弧对电子,其VSEPR模型为_________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________ ___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行aN(g)![]() bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中=______。
(2)t2时两线交叉点__平衡状态(填“是”或“不是”),v正__v逆(填“>”“<” 或“=”)。
(3)此反应达到平衡时,反应物的转化率为____________。
(4)下列描述能说明上述反应达到平衡状态的是__________。
①反应中M与N物质的量之比为2∶5 ②混合气体的总物质的量不随时间的变化而变化③M的转化率达到最大 ④如容器为绝热容器,体系内温度不再变化
II某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色)![]() 2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
(1)前4 s以N2O4浓度变化表示的平均反应速率为 。
(2)在4 s末时容器内的压强是开始时的 倍。
(3)平衡时容器内NO2的浓度是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
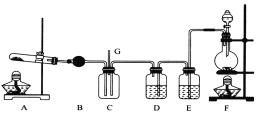
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
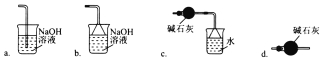
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)y在元素周期表中的位置是_______。z、d、e、f四种元素的简单离子中,半径最小的是______(填离子符号)。
(2)g和h氢化物的稳定性由大到小的顺序:_______(用化学式表示)。
(3)元素e和g的同族元素中半径最小元素组成的化合物B中离子半径较大的是______(填离子符号)。
(4)下列可作为比较f和Na随金属性强弱的依据是____。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱(或酸)性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)有人建议将氢元素排在元素周期表的IVA族,请你从化合价的角度给出一个理由_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
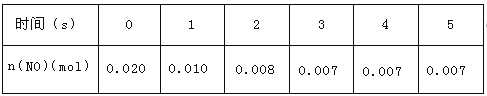
(1)下图表示NO2的变化曲线是_____。用O2表示从0-2s内该反应的平均速率v=____。
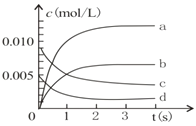
(2)能说明该反应己达到平衡状态的是_____(填字母序号,下同)。
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆(NO)=2v正(O2 )
d.容器内气体的密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是_____。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com