
科目: 来源: 题型:
【题目】Ni和Fe在工业生产和新型材料领域有广泛的应用,黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制硫酸;回答下列问题:
(1)将FeS2与稀盐酸所对应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________;
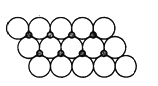
(2)FeS2的晶体中的Fe2+离子的排列方式如下图所示:

①每个Fe2+周围最近的等距离的S22-离子有________个;
②已知FeS2的晶胞参数是a0=54nm,它的密度为_____________gcm-3;(列式并计算,阿伏加德罗常数为6.02×1023)。
(3)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为___________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为________g(氧离子的半径为1.40×10-10m,![]() =1.732)。
=1.732)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知。Ksp(PbSO4)=1.6×10 -8) 和Ksp(PbCO3)=1.4×10-14
(1)写出铅酸蓄电池放电时的总反应: __________。
(2)废旧电池的预处理时需要将电池放电完全,目的是__________。
(3)写出铅膏脱硫时的离子方程式__________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是__________。
(5)已知芒硝(Na2SO4·10H2O)的溶解度曲线如下图所示,则从Na2SO4溶液中结晶出Na2SO4晶体的方法是加热结晶、__________、用乙醇洗涤晶体。用乙醇不用水洗涤的原因是__________。

(6)应用电化学原理,将铅膏转化为铅可以非常清洁处理蓄电池,其原理是先用细菌将铅膏转换为PbS,再用氟硼酸铁浸出PbS,化学方程式为:
PbS+2Fe[BF4]3=Pb[BF4]2+2Fe[BF4]2+S
最后通过电解浸出液得到金属铅,电解后的溶液可以循环使用,写出电解的总反应方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO2与N2O4相互转化:2NO2(g)![]() N2O4(g);△H=﹣24.2kJ/mol。在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图。下列推理分析合理的是( )
N2O4(g);△H=﹣24.2kJ/mol。在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图。下列推理分析合理的是( )
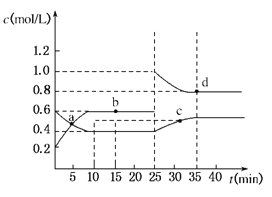
A.a,b,c,d四点中V正与V逆均相等
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.前10min内,用v(NO2)表示的该反应速率为0.02mol/Lmin
D.25min时,导致平衡移动的原因是升温
查看答案和解析>>
科目: 来源: 题型:
【题目】石油裂解气是重要的化工原料,以裂解气为原料合成有机物X(![]() )的流程如图:
)的流程如图:

( )
)
请回答下列问题:
(1)反应①的反应类型是_________
(2)B的名称是_________,D分子中含有官能团的名称是_________。
(3)写出物质C的结构简式_________。
(4)写出A生成B的化学方程式_________。
写出反应③的化学方程式_________。
(5)满足以下条件D的同分异构体有_________种:
①有相同的官能团;②含有六元环:③六元环上有2个取代基。
(6)参照F的合成路线,设计一条由CH3CH=C HCH3制备![]() 的合成线路(其他试剂任选)。
的合成线路(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
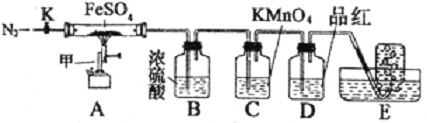
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
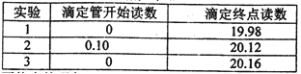
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式 甲: 乙: C: H: 。
(2)写出反应⑦的离子方程式: ________。
(3)要除去物质F中的物质G,可行的方法是( )
A.滴入KSCN溶液 B.通入足量的氯气 C.滴入NAOH溶液 D.加入过量铁粉
(4)若将D溶液滴入F溶液中,将其长时间露置于空气中观察到的现象为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体。

(1)写出有关的物质化学式。X: C: E: F:
(2)写出反应①的化学方程式_____________________________________
(3)写出反应②的离子方程式_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:_______。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为 , 第三周期中除⑩元素以外离子半径最小的是 (填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是 (填化学式),元素⑦的氢化物的结构式为 ; 该氢化物和元素④单质反应的化学方程式为 。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为 。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为 。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式 ;④⑧⑨元素的离子的还原性由强到弱顺序为 (用离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮有不同价态的氧化物,如NO、N2O3、NO2, N2O5等,它们在一定条件下可以相互转化。
(1)己知:2NO(g)+O2(g) =2NO2(g)△H1=-113kJ/mol
NO(g)+O3(g)=NO2(g)+O2(g) △H2=-199 kJ/mol
4NO (g)+O2(g) =2N2O5(g) △H4=-57 kJ/mol
则反应6NO2 (g)+O3(g)=3N2O5(g) △H=__________。
(2)某温度下.在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3![]() NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________

A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图像与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).


(4)对于反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水生产的流程示意图见下:

(1)二氧化氯(ClO2)是一种高效、安全的水处理剂,比C12好。有如下两种制备C1O2方法:
方法一:2NaClO3+4HCl=2C1O2↑+Cl2↑+2NaCl+2H2O
方法二:2NaC lO3 +H2O2+H2SO4=2C lO2↑ +Na2SO4十O2↑+2H2O
用方法二制备的C1O2更适合用于饮用水消毒,其主要原因是__________。
C1O2和C12在消毒时自身均被还原为Cl-, C1O2的消毒能力是等质量Cl2的_________倍
(2)含有较多的钙、镁离子的水被称为硬水。暂时硬水最常见的软化方法是_________。
永久硬水一般可以使用离子交换树脂软化,先把水通过装有_________ (填“阴”或“阳”)离子交换树脂的交换柱,再通过另一种功能的离子交换树脂。使用后的阳离子交换树脂可以置于_________中再生。
(3)水处理中常见的混凝剂有硫酸铝、聚合氛化铝、硫酸亚铁、硫酸铁等。硫酸亚铁作为混凝剂在除去悬浮物质时,需要将水的pH调至9左右,原因是_________。
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法.下图是电渗析法的示意图,淡水从_________(填“A”、“B”或,“C”)口流出,甲为_________离子交换膜。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com