
科目: 来源: 题型:
【题目】)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是____________。
(2)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(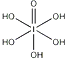 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为______ 。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列________式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg·cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为apm,则CaF2的相对分子质量可以表示为________________(用含a的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
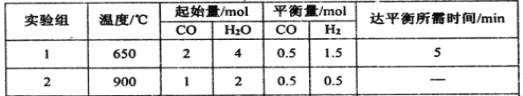
① 实验1中,前5min的反应速率v(CO2)= 。
②下列能判断实验2已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
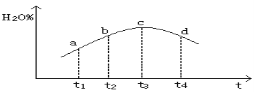
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示, b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
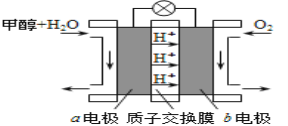
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是 ( )
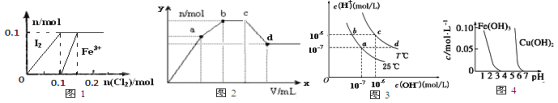
A.图1表示向100mL 1 mol·L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系
B.图2表示向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液,沉淀物质的量变化的关系
C.图3表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在NaCl溶液中滴加AgNO3溶液, 反应的离子方程式为:__________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_______________________________
(3)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
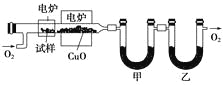
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12 g有机物X的蒸气氧化产生7.04 g二氧化碳和1.80 g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
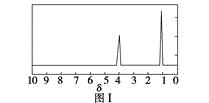
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。
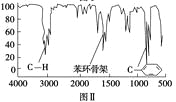
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的习惯命名为 。
(2)步骤二中的仪器分析方法称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ X2Y
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是 (写化学式)。
(3)写出实验室制取X的单质的离子方程式 _______________。
(4)Z的单质能否与氢氧化钠溶液发生反应: (填“能”或“否”),若能,请写出反应的离子方程式: _______________。
(若不能反应,则此空不必填写)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
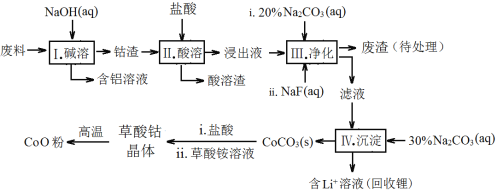
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式 。
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是 ;废渣中的主要成分为 。
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,[M(CoC2O4·2H2O) = 183 g/mol ] 受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/ g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—有机化学基础】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:


回答下列问题:
(1)![]() 生成A的反应类型是 。
生成A的反应类型是 。
(2)F中含氧官能团的名称是 ;试剂a的结构简式为 。
(3)写出由A生成B的化学方程式: 。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:。
(5)当试剂d过量时,可以选用的试剂d是 (填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)写出C与足量NaOH在一定条件反应的化学方程式 。(不用写条件)
(7)肉桂酸有多种同分异构体,符合下列条件的有 种。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg。
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式 (任写一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1)BCD三种元素中电负性最大的元素其基态原子的电子排布图为____________;
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在B的基态原子中,核外存在____________对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有______个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色所对应,其原因是____________;E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为_______。该化合物的电子式为_______。

(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因____________;
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,请写出该阳离子与SO2的水溶液所对 应的离子方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国著名的化学家侯德榜先生(下图)改革国外的纯碱生产工艺,生产流程表示如下:

![]()
(1)沉淀池中发生的化学反应方程式是
________________________________________________________________________
________________________________________________________________________。
(2)写出上述流程中X物质的分子式________。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________________。
(5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________(填编号字母)。
(a)增大NH的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目: 来源: 题型:
【题目】用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是
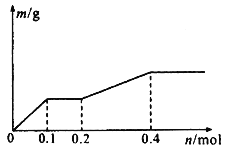
A. Ag+>X3+>Cu2+>H+>X2+
B. Ag+>Cu2+>X3+>H+>X2+
C. Cu2+>X3十>Ag十>X2+>H+
D. Cu2+>Ag+>X3+>H+>X2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com