
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】硼和氮元素在化学中有很重要的地位,回答下列问题:
(1)基态硼原子核外电子有____ ____种不同的运动状态,基态氮原子的价层电子排布图为_________________。预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2]。(CH3)2NNH2中N原子的杂化方式为_________。
(2)化合物H3BNH3是一种潜在的储氢材料,可利用化合物B3N3H6通过如下反应制得:3CH4+2B3N3H6+ 6H2O=3CO2+6H3BNH3
①H3BNH3分子中是否存在配位键_______________(填“是”或“否”),B、C、N、O的第一电离能由小到大的顺序为___________________。
②与B3N3H6互为等电子体的分子是_____________(填一个即可),B3N3H6为非极性分子,根据等电子原理写出B3N3H6的结构式____________________________。
(3)“嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为_____________。
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 。

③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为_________________(用含a的代数式表示,设NA为阿
pm,则该晶体的密度为_________________(用含a的代数式表示,设NA为阿
伏伽德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[![]() ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,![]() 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是
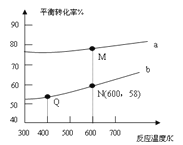
A.曲线b所对应的投料比为3:1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。

请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D是短周期元素的气态单质,其中A是黄绿色的气体单质,C在空气中含量最高,D是最轻的气体;E是一种最常用的金属;Y是一种常见的液态物质,Z是唯一显碱性的气体; M是一种红棕色的有毒气体;I为红褐色难溶于水的固体。有关的转化关系如下图所示(反应条件均已略去)。
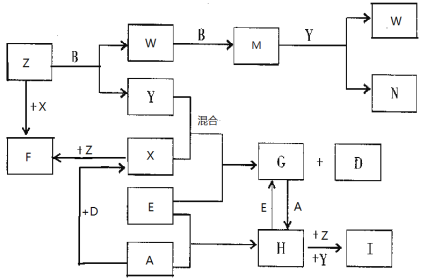
回答下列问题:
(1)A的组成元素在元素周期表的位置为 ;
(2)F中化学键的类型是 、 ;(每空2分,共4分)
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为 ;
(4)I为红褐色难溶于水的固体,与“84消毒液”的有效成分(NaClO) ,在浓碱溶液中发生反应生成了高效环保的净水剂高铁酸钠,请写出此反应的离子方程式 。
(5)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
g。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
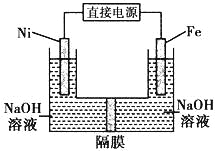
A. 镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氨的水溶液叫做氨水。用离子方程式表示氨水成碱性的原因_________。
(2)实验室制备氨气,下列方法中可以选用的是 ____________。
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热
(3)管道工人曾经用浓氨水检验氯气是否漏气。在有水蒸气存在的条件下能发生反应 2NH3+3Cl2=6HCl+N2。反应中如果有1.7克氨气被氧化,则被还原的氯气体积为__________L(标准状况下)。如果氯气管道漏气,用该方法检验时的现象是_______________________________。
(4)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。氨催化氧化的化学方程式为________________。将铂铑合金做成薄丝网的主要原因是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1
2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)![]()
C(g)+D(g) △H>0的化学平衡,时间速率图像如右图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
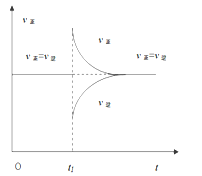
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。

(6)在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学―选修 3 物质结构与性质】
氮族元素(Nitrogen group)是元素周期表VA 族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种。
(1)氮族元素的外围电子排布式的通式为 ;基态磷原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)PH3分子的VSEPR模型为______________,键角NH3 H2O(填“>”、“<”或“=”)。
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为 。
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是 。
②NH3易与Cu2+反应,而NF3却不能,其原因是 。
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则硼原子的配位数为________;已知磷化硼的晶胞边长a=" 478" pm,计算晶体中硼原子和磷原子的核间距(dB-P)=__________pm(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甘草甜素在治疗丙肝、艾滋病、非典等疾病方面有一定疗效。甘草甜素在一定条件下可转化为甘草次酸。下列有关说法正确的是

A. 甘草甜素转化为甘草次酸属于酯的水解
B. 在Ni催化作用下,1mol 甘草次酸最多能与3molH2发生加成反应
C. 甘草甜素中含有羧基、羰基、碳碳双键、酚羟基等官能团
D. 甘草甜素、甘草次酸均可与Na2CO3、溴水等无机试剂发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】把下列物质分别加入盛冷水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列
哪些物质后,发生如图变化( )

①NaOH粉末;②浓硫酸;③硝酸铵晶体;④过氧化钠固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com