
科目: 来源: 题型:
【题目】【化学—选修5有机化学基础】
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:

已知:
i.1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。
ii.![]()
iii. (R1、R2、R3为烃基或氢原子) 请回答:
(R1、R2、R3为烃基或氢原子) 请回答:
(1)B→C的反应类型是 。
(2)C→D反应的化学方程式是 。
(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是 。
E→G反应的化学方程式是 。
(4)下列有关香兰醛的叙述不正确的是 。
a.香兰醛能与NaHCO3溶液反应
b.香兰醛能与浓溴水发生取代反应
c.1 mol香兰醛最多能与3 molH2发生加成反应
(5)写出一种符合下列条件的香兰醛的同分异构体的结构简式 。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 molNaOH
(6)姜黄素的分子中有2个甲基,其结构简式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为1/3Fe2O3(s)+CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
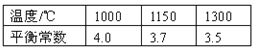
请回答下列问题:
(1)该反应的平衡常数表达式K= ,由于随着温度升高,平衡常数减小,所以正反应是 热反应(填“吸”或“放”);
(2)欲提高反应中CO的平衡转化率,可采取的措施是 ;
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.加入合适的催化剂
E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡。求该时间范围内反应的平均反应速率:v (CO2)= 、CO的平衡转化率= 。(要书写解题过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】硝基苯是一种重要的化工原料,其制备原理是:
![]()
![]()
在温度稍高的情况下会生成副产物间二硝基苯: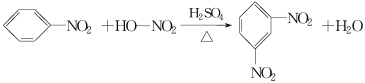
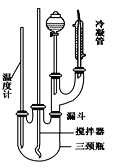
请将下列制备硝基苯的实验内容填写完整:
(1)混酸的配制:取100 mL烧杯,用浓硫酸20 mL、浓硝酸18 mL配制混酸,其操作过程为__________________________________
(2)安装反应装置:按图所示安装实验装置,在这个实验中冷凝管的作用是 _
(3)反应步骤:①把18 mL的苯加入到三颈瓶中,将混酸加入到分液漏斗中,逐滴滴加混酸,边滴加边搅拌,这样做的目的是____________________________ _
②混酸滴加完毕后,在加热搅拌的条件下反应半小时。控制加热温度的方法是___ ____ 。
③分离和提纯:除去产物中没有反应的酸,可在产物中加入碱溶液,然后用分液漏斗分液,______层物质为粗产品。除去硝基苯中没有反应的苯和生成的副产物的简便方法是(填方法名称)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3物质结构与性质】
原子序数依次增大的四种元素A、B、C、D依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,用最简式表示该晶胞的空间利用率 。
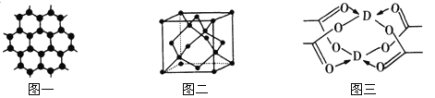
(4)D元素形成的单质,其晶胞内D原子的配位数为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)D元素形成的单质,既不溶于氨水也不溶于双氧水,但溶于两者的混合溶液。写出该反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
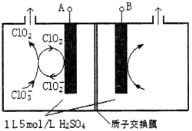
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知热化学方程式:Zn(s)+1/2O2(g) =ZnO(s) △H1;Hg(l)+1/2O2(g) =HgO(s) △H2;
则Zn(s)+HgO(s)=Hg(l)+ZnO(s) △H值为 。(用△H1和△H2的代数式表示)
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。若反应中4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
2Cl2(g)+2H2O(g)。若反应中4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
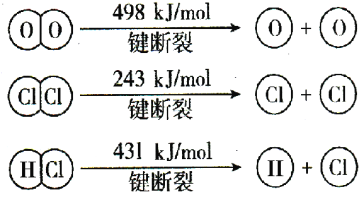
①反应A的热化学方程式是 。
②断开1 mol H—O键,需要吸收的能量为 kJ,H2O中H—O 键与HCl中H—Cl键相比, 的键能较大。(填“H—O”或“H—Cl”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍, 则该烃的分子式 。
(2)某烷烃B含有16个共价键,则该烃的同分异构体有 种。
(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,则该烃的一氯取代物有 种。
(4)某烃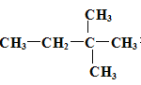 由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据化学反应与能量转化的相关知识,试回答下列问题:
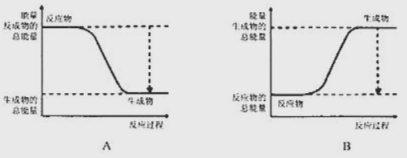
(1)已知![]() ,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反正中能量变化的是___(填序号)。
,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反正中能量变化的是___(填序号)。
(2)已知:氢氧燃料电池的总反应方程式为2H2O+O2=2H2O。在碱性条件下,通入氢气一端的电极反应式为_________________。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
(3)已知断开1mol N≡N键需要946kJ的能量,断开1mol H—H键需要436kJ的能量,生成1moN—H键放出391kJ的能量,试计算生成2mol NH3时会______(填“放出”或“吸收”)______kJ能量。当在相同的条件下向容器中充入1molN2和3molH2时,它们反应对应的热量______(填“大于”、“等于”或“小于”)你所计算出的值,原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
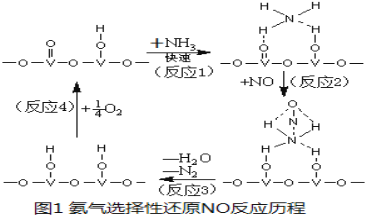
①写出总反应化学方程式 。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是 反应(填“吸热”或“放热”)。
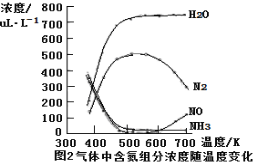
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式 。
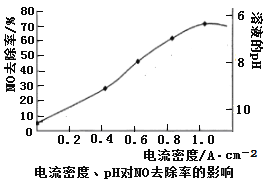
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。
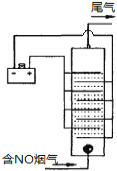
①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式 。
②溶液的pH对NO去除率影响的原因是 。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2。列式计算实验中NO除去率 。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
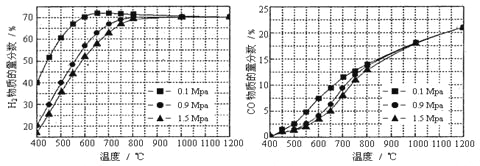
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com