
科目: 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为 。D在周期表中位置 。
(2)写出E的电子式: 。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】推断题
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
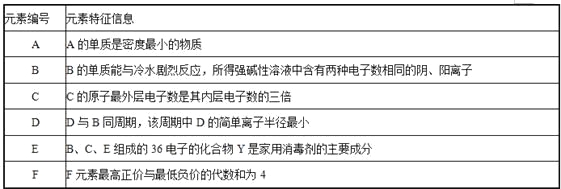
(1)写出下列元素名称:A B C D E F .
(2)写出元素C的离子结构示意图____________。
(3)D、E、F的简单离子半径由大到小的顺序是 。
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为_______________。
(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为 。
(6)D与E形成的化合物的类别是________________(填共价化合物或离子化合物)。
(7)能证明C的非金属性比F强的实验事实是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】填空题
(1)已知断裂1 mol C-H, O=O,C=O,H-O化学键所需能量分别为a KJ,bKJ,cKJ,dKJ,则该反应CH4 + O2 = CO2 + 2H2O 的反应热为ΔH= kJ·mol-1
(2)N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则该反应的热化学方程式是 。
![]() (3)某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
(3)某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
(4)试比较下列三组ΔH的大小(填“>”、“<”或“=”)
A.A(g)+B(g) = C(g) ΔH1<0 A(g)+B(g) = C(l) ΔH2<0 则ΔH1____ΔH2
B.S(g)+O2(g) = SO2(g)ΔH1<0 S (s)+O2(g) = SO2(g) ΔH2<0 则ΔH1____ΔH2
C.C(s)+O2(g) = CO2(g)ΔH1<0 C(s)+O2(g) = CO(g) ΔH2<0 则ΔH1____ΔH2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常利用铝粉和氧化铁反应来焊接铁轨。下列说法正确的是
A.氧化铝、氧化铁均为两性氧化物
B.氧化铝中的微粒半径:r(Al3+)>r(O2-)
C.在该反应中,铝的还原性强于铁的还原性
D.1mol氧化铁参加反应转移电子数约为4×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为 。NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-) C(AsO33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式: 。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3。写出上述鉴定过程中有关反应的化学方式: 。
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为 。
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为 。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为 (填“P”或“Q”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4)Z2Y2中的化学键类型是_____________________;Z2Y2与水反应放出气体的离子方程式为
________ _____。
(5) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2![]() Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
查看答案和解析>>
科目: 来源: 题型:
【题目】异苯丙醛 在工业上有重要用途,其合成流程如下:
在工业上有重要用途,其合成流程如下:

(1)异苯丙醛被酸性高锰酸钾氧化后所得有机物的结构简式是____________。
(2)在合成流程上②的反应类型是____________,反应④发生的条件是____________,
(3)反应⑤的化学方程式为____________。
(4)异苯丙醛发生银镜反应的化学方程式为__________。
(5)D物质与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的名称是____________。D物质有多种同分异构体,其中满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有____________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应②逆反应③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属单质在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置:____________,UW2的电子式为____________;
(2)写出下列反应的化学方程式,Z在高温下与水反应_______________________________________;
(3)U、V、W形成的10电子氢化物中,氢化物的稳定性从强到弱的顺序是____________(写化学式),V元素的氢化物极易溶于水的主要原因是__________________________,该氢化物与空气可以构成一种环保燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com