
科目: 来源: 题型:
【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:![]() 。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
A.①② B.③④ C.②③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l);△H=-572kJ/mol
②2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol
③CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-890kJ/mol
(1)已知H-H的键能436kJ/molO=O的键能496kJ/molH-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出 。并计算写出反应 H2O ( l ) = H2O ( g )的焓变△H= 。
(2)请根据题干计算CO2(g)+4H2( g ) =CH4( g ) +2H2O( g )的焓变△H= 。
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式 。(填反应方程式的序号)标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为263.8kJ,试求混合气体中甲烷和氢气体积比 。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )

A.S2Cl2的电子式为![]()
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 +2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
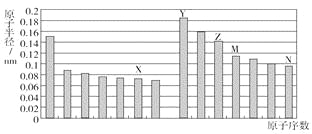
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的稳定性相比,前者较弱
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】将适量AgBr固体溶在水中,溶液中存在AgBr(s)![]() Ag+(aq)+Br-(aq)。则下列说法正确的是( )
Ag+(aq)+Br-(aq)。则下列说法正确的是( )
A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr)
B.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-)
C.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大
D.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如右图所示的原电池,下列说法正确的是( )。
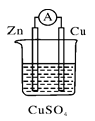
A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:下列说法正确的是( )
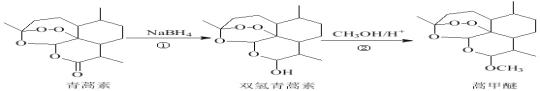
A.①、②反应依次为还原反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
查看答案和解析>>
科目: 来源: 题型:
【题目】硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 .
(2)下列有关硅材料的说法正确的是 (填字母)。
A.高纯度的硅,可用于生产光电池,将光能直接转换为电能
B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维
D.普通玻璃是由纯碱.石灰石和石英砂制成的
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡原理是中学化学学习的重要内容,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气(主要成分CO、H2)制备甲醇。
(1)己知:CO、H2、CH3OH、的燃烧热(△H)分别为-283.0kJ/mol、-241.8kJ/mol、-192.2 kJ/mol,请写出合成气制备甲醇的热化学方程式 。
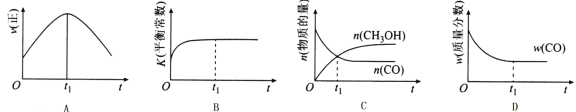
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
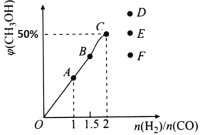
(3)在T1℃时,在体积为5 L的恒容容器中充入3 mol的合成气,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。H2和CO按2:1投入时经过5 min达到平衡,则5 min内用H2表示的反应速率为v(H2)=_______。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
(4)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:________________________。
(5)水的自偶电离可表示为H2O+H2O![]() H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com