
科目: 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
A.v(N2)=0.25mol·Lˉ1·minˉ1 B.v(H2)=0.5mol·Lˉ1·minˉ1
C.v(NH3)=1mol·Lˉ1·minˉ1 D.v(NH3)=0.25mol·Lˉ1·minˉ1
查看答案和解析>>
科目: 来源: 题型:
【题目】【加试题】I.无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42g离子化合物D,D的水溶液的pH<7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
Ⅱ.雾霾已经成为社会各界共同关注的热门话题,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①该反应在低温下能自发进行,该反应的△H 0。(选填“>”、“<”)
②在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如右图所示(已知:t2-tl = t3-t2)。则下列说法不正确的是 。(填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
C(s)+H2O(g)![]() CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
H2O(g)+CO(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3

①△H3和△H1、△H2的关系为△H3= 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在右图中画出tl时刻后H2的体积分数变化趋势曲线。(t2时刻重新达到平衡)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号______;
(2)C的阴离子的结构示意图______;
(3)C、D两元素形成的化合物的电子式__________________________。
(4)A、B两元素相比较,A元素的活泼性较强,可以验证该结论的实验是( )
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.
(5)写出D的氢化物与C的单质1:2反应的化学方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
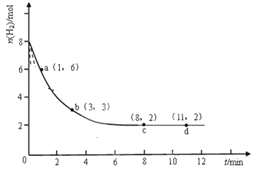
(1)0-a,a-b,b-c,c-d四段中,平均反应速率最大的时间段是 ,该时间段内H2的平均反应速率是 。
(2)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(3)平衡时CO2的转化率是 ;反应前后容器内的压强比是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】i.利用下图装置可验证同主族元素非金属性的变化规律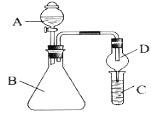
(1)仪器A的名称为______,干燥管D的作用是______。
(2)若要证明非金属性:C1>I,则A中加浓盐酸,B中加______(填名称),C中加淀粉-碘化钾溶液,观察到C中溶液______的现象,即可证明。从环境保护的观点 ,此装置的不足之处是_________。
(3)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加_________(填试剂)即可证明。乙同学认为此方案有不足之处,应在B、D两装置间加装有_________(填试剂)的洗气瓶。
ii.金属Na、Mg、Al有广泛的应用
(4)金属Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0g金属钠和镁,分别加入到5mL水中,钠与谁反应剧烈,镁与水反应缓慢。
实验2:各取1.0g的镁条和铝条,分别加入到5mL1.0mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
实验1和实验2得出的结论是_________,用原子结构理论解释;同周期元素从左到右,_________。
(5)Na、Mg、Al都可用于制备储氢的金属氢化物。
① NaH是离子化合物,其电子式为_________。能与水发生氧化还原反应生成H2,该反应的还原剂是_________。NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学式为_________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取。某化学实验小组以8.0g TiO2和足量 CCl4为原料制取TiCl4。装置图如下:
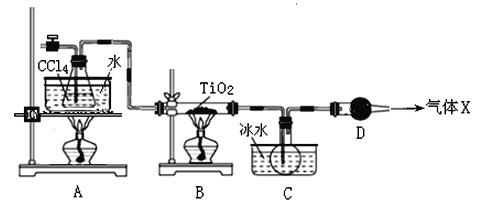
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题
(1)TiCl4中化学键的类型是 。
(2)B中TiO2发生反应的化学方程式是 。
(3)X气体的主要成分是 。
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
(5)欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
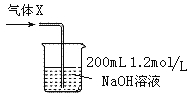
(6)若将反应过程中生成的气体X全部通入到下图所示的装置中充分反应,生成的盐是 (填化学式),生成盐的总物质的量n≤ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
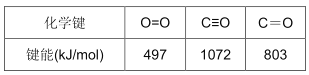
则反应:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
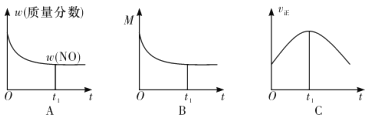
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g)![]() 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:
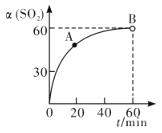
则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。
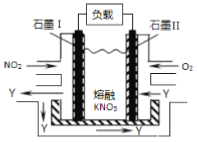
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含有的较少的H+和OH-):Na+、NH4+、SO42-、CO32-、NO3-。取200 mL该溶液,分为两等份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+) ≥ 0.1 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】干电池原理如右图所示,电池总反应为Zn+2NH===Zn2++2NH3↑+H2↑。下列说法正确的是( )

A.Zn极上发生还原反应
B.碳电极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH+2e-===2NH3↑+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列仪器组装一套蒸馏石油的装置,并进行蒸馏得到汽油和煤油。
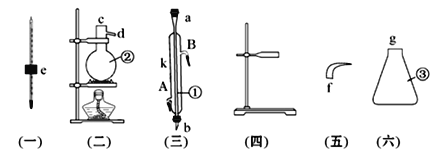
(1)写出下列仪器的名称:
①__________________;②___________________;③_________________。
(2)将以上仪器按从左到右顺序,用字母a、b、c……进行连接:
e接__________;_________接_________;_________接_________
(3)①仪器的A口是__________,B口是__________。
(4)蒸馏时,温度计水银球应在______________________(位置)。
(5)在②中注入原油后,加几片碎瓷片的目的是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com