
科目: 来源: 题型:
【题目】乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:
(1)乙醇的结构简式为CH3CH2OH,乙醇分子含有的官能团为 ;
(2)生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸 碳酸(填“>”或“<”);
(3)在浓硫酸的催化作用下,加热乙酸和乙醇的混合溶液,可发生酯化反应。请完成化学方程式:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ 。
CH3COOCH2CH3+ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH

②过二硫酸铵是一种强氧化剂。
![]()
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
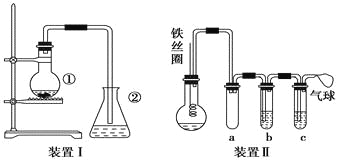
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①中的化学方程式为______________________________________。
②中离子方程式为_______________________________________。
(2)①中长导管的作用是__________________________。
(3)烧瓶中褐色油状液滴中有机物的成分是________,要想得到纯净的该产物,可用______ __洗涤。洗涤后分离粗产品应使用的仪器是____ ____。
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_______________________________________。
b中的试剂是____________________________________。
比较两套装置,装置Ⅱ的主要优点是
_____________________________________________________________
_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
【甲同学】 设计了如图1装置来一次性完成验证非金属性S>C>Si的实验研究;
【乙同学】 设计了如图2装置来验证卤族元素性质的递变规律。
A、B两处分别是浸有NaBr溶液的棉花、湿润的淀粉KI试纸,

(1)①甲同学设计实验的依据是 。
② A溶液的名称是 。
③ 烧杯中C发生反应的离子方程式为 。
(2)乙同学的实验原理是通过观察玻璃管中的实验现象,验证卤族元素性质的递变。
① 写出A处发生反应的离子方程式 。
② B处的实验现象为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向可变容积的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K = ,若降低温度,K值将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将___(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将 (填“增大”“减小”或“不变”),理由是___________________________。
(3) 达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将________(填“增大”、“减小”或“不变”)。
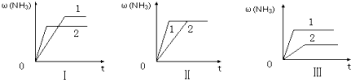
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图。下列说法正确的是 (填序号)。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2
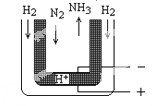
(5)常压下,把H2和用He稀释的N2分别通入一个570℃的电解池装置(下图),H2和N2便可在电极上合成氨,装置中的电解质(图中黑细点处)能传导H+,则阴极的电极反应式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:


(1)仪器A中发生反应的化学方程式是______;装置B中的试剂是_______。
(2)若撤去装置C,可能导致装置D中副产物_____(填化学式)的量增加;装置D可采用 加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________。
(4)装置E中可能发生的无机反应的离子方程式有_________________。
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mo1·L-1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。(CCl3CHO的相对分子质量为147.5)滴定的反应原理:CCl3CHO+OH-==CHCl3+HCOO-、HCOO-+I2==H++2I-+CO2↑ 、I2+2S2O32-==2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka (CH3COOH)= 1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸按是一种常用的化肥,其工业生产流程如下图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式: 。
(2)吸收塔C中通入空气的目的是 。C、D两个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
(3)浓硝酸一般保存在徐色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
(4)3.04g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.00mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则
① 加小Na0H 溶液的体积至少 mL。
② 该合金中铜与镁的物质的量之比是 。
③ NO2和N2O4的混合气体中,NO2的体积分数是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:①CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
②F的结构简式:
以下是该有机物F的合成路线,请填写下列空白。

(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出与D互为同分异构体,结构中含有苯环且苯环上含有一个乙基(苯环上的取代基处于对位)的酯类的结构简式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙炔常因含杂质生成少量H2S,有人设计了下列实验以确证上述混合气体中含有乙炔和H2S。
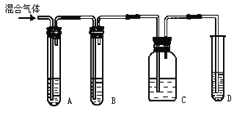
(1)如图所示A、B、C、D装置中可盛放的试剂是(填序号)
A.________; B.________; C.________; D.______。
①CuSO4溶液 ②NaOH溶液 ③溴水 ④KMnO4酸性溶液
(2)能说明H2S气体存在的现象是___ _____,
(3)使用装置B的目的是______ _,
(4)使用装置C的目的是___ ,
(5)确证含有乙炔的现象是___ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O反应中,
CuSO4 + SO2↑+ 2H2O反应中,
(1) 元素被氧化, 是氧化剂,还原产物是 。
(2)用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(3)若有2mol的H2SO4参与反应,则被还原的H2SO4为 g 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com