
科目: 来源: 题型:
【题目】某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛。其结构如下,对该“光敏性高分子”,下列叙述正确的是( )

A.化学式为(C11H11O2)n
B.它能发生加成反应,不能发生水解反应
C.它可以和FeCl3溶液发生显色反应
D.1mol该分子最多能和4n mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。① ③ ② ④ ⑤ ⑥ n
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知: 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
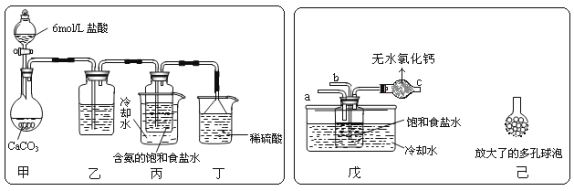
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
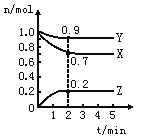
(1)该反应的化学方程式为 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均分子量比起始投料时_______ _____(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸在化学工业中有着极其广泛的应用。
(1)将1.25 mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4 mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8 g/cm3)以下时,则失去吸水能力。50 mL 18.4 mol/L的浓硫酸作为吸水剂时,最多可吸水__ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比![]() =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x = 。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:①2NO+Na2O2=2NaNO2 ②2NO2+Na2O2=2NaNO3③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣还原成Mn2+。
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目__________
(2)B装置的作用是_______
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有硝酸钠、碳酸钠、氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)_____________________
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
![]()
(5)第一组实验数据出现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束仰视读数
D.滴定结束俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数________(结果保留4位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,甲,乙所用的离子膜为同一类型。

①甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
②经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
③图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
查看答案和解析>>
科目: 来源: 题型:
【题目】合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+ H![]() (g)==zMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mLg-1min-1。反应的焓变△H(Ⅰ)_____0(填“>”“<”或“=”)
(g)==zMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mLg-1min-1。反应的焓变△H(Ⅰ)_____0(填“>”“<”或“=”)

(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过________或________的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H![]() 合成CH
合成CH![]() 的反应,温度为T时,该反应的热化学方程式为_______ 。已知温度为T时:CH
的反应,温度为T时,该反应的热化学方程式为_______ 。已知温度为T时:CH![]() (g)+2H2O=CO
(g)+2H2O=CO![]() (g)+4H
(g)+4H![]() (g) △H=+165KJmol1
(g) △H=+165KJmol1
CO(g)+H2O(g)=CO![]() (g)+H
(g)+H![]() (g) △H=-41KJmol1
(g) △H=-41KJmol1
查看答案和解析>>
科目: 来源: 题型:
【题目】 (实验)某芳香烃A有如下转化关系:按要求填空:
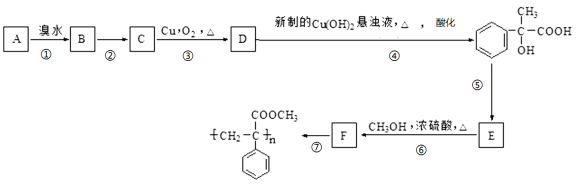
(1)写出D中所含官能团的名称 ,指出⑤的反应类型 。
(2)反应②的反应条件是 。
(3)写出A和F结构简式:A ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式: 。
(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com