
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为_________ |
(2)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为________________ |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A中含有的官能团__________、____________。 |
(4)A的核磁共振氢谱如下图: | (4)A中含有______种氢原子。 |
(5)综上所述,A的结构简式为_____ ___。 | |
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
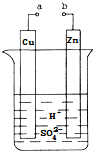
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的有儿项( )
①1L0.1mol/LK2Cr2O7溶液中Cr2O72-的数目小于0.1NA
②1molCl2做氧化剂时得到的电子数为2NA
③25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
④过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
⑤50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
⑥利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图).若原料完全反应,得到1mol产物同时生成3NA个H2O

A.2 C.4 B.3 D.5
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应:![]() 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应
![]() 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):

(1)Ⅰ的分子式为_____________;
(2)反应①的反应类型是_____________,反应④的反应类型是_____________。
(3)写出反应②的化学反应方程式____________ _________。
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为_____________________。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写两种)。
(6)一定条件下,![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用.
Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。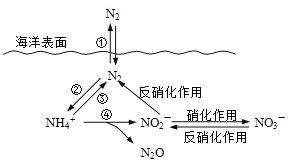
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________。
Ⅱ.工业合成氨原理是:N2(g)+3H2(g)![]() 2NH3(g) △H <0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H <0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
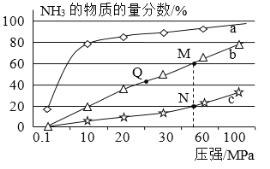
(3)曲线a对应的温度是 。
(4)关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.上图中M、N、Q点平衡常数K的大小关系
是K(M)=K(Q)>K(N)
C.M点比N点的反应速率快
D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100%
(5)如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K= L2/mol2 (精确到小数点后两位)。
Ⅲ.尿素是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) ΔH=-272kJ·mol-1
H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(6)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________。
(7)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
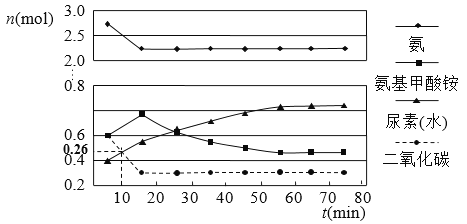
①反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=
mol/(L·min)。
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeC13发生显色反应,也能和Na2CO3反应
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
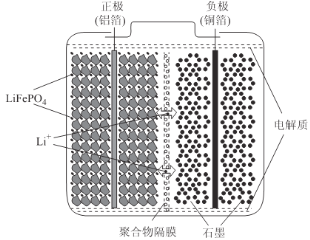
电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率=![]() 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)按要求回答下列有关问题。
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量。化学上,规定标准状况下稳定单质的生成热为0。几种物质的生成热:NH3(g)为mkJ·mol-1,H2O(l)为nkJ·mol-1。
反应的△H=产物的生成热之和---反应物的生成热之和
②几种化学键的键能数据如下:
![]()
上述反应中,△H=_______kJ·mol-1,H-N键的键能为_______kJ·mol-1。
(2)二氧化硫在一定条件下可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=_____________________;
②实验丙中,达到平衡时,NO2的转化率为____________;
③由表中数据可推知,Tl______T2(填“>”“<’’或“=”);
(3)对反应N2O4(g)![]() 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同)

①铁电极应连接直流电源的____________(填写电极名称)。
②上述反应方程式配平后“□”内应填写________;
③阳极上发生的电极反应为2Cl--2e-=Cl2↑和_______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com