
科目: 来源: 题型:
【题目】下图是一种蓄电池的示意图。被膜隔开的电解质分别为Na2S2和NaBr3,放电后变为Na2S4和NaBr。已知放电时Na+ 由乙池向甲池移动。下面对该装置工作过程中叙述正确的是
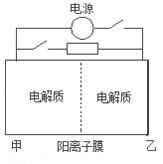
A.放电过程,甲池发生氧化反应
B.放电过程,电池反应:2S22-+ Br3-= S42-+ 3Br-
C.充电过程,乙池为阳极室
D.充电过程,当阳极室阴离子增加2mol,整个电路中电子转移2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
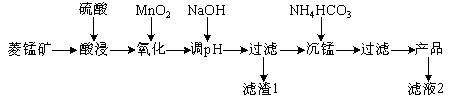
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)![]() H3CuCl4(aq)。
H3CuCl4(aq)。
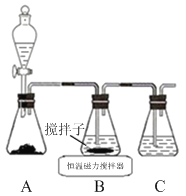
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O===2CuCl43-+SO+4H+
CuCl43-(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是
操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
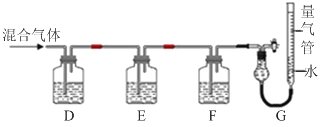
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
①D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列反应中,属于放热反应的是 ,属于吸热反应的是 。①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(3)14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、 下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 (在横线上填相应的序号)
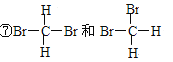
A、互为同位素的是_________ ; B、互为同分异构体的是________;
C、互为同素异形体的是________; D、同一种物质的是_________。
Ⅱ、 写出下列烷烃的分子式
(1)含有30个氢原子的烷 ;
(2)假如某烷烃的相对分子质量为142,则该烷烃的分子式为 ;
(3)烷烃A在同温同压下蒸气的密度是H2的36倍 ;
(4)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L水蒸气 。
Ⅲ、甲烷的电子式为________,碳氢键之间键角为 。甲烷和氯气在光照下发生取代反应,生成___________种产物。产物中_________常用作灭火剂。试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
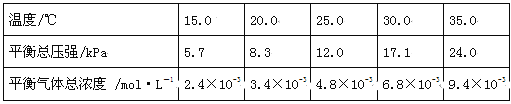
①可以判断该分解反应已经达到平衡的是 。(填编号)
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH 0(填“>”、“=”或“<”),熵变ΔS 0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2![]() NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
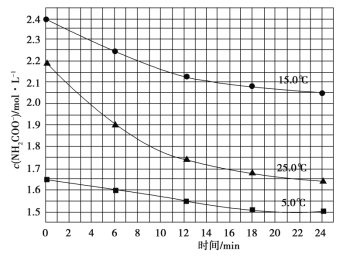
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率 。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
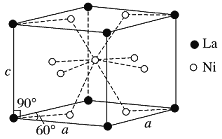
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断
提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w..c.o.mⅠ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是一种重要的化工原料,可以参与合成很多物质。下图为以甲苯为原料得到药物苯佐卡因的合成路线。
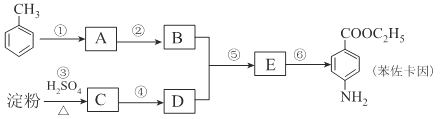
已知:i.苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位;
Ⅱ.![]() (有弱碱性,易被氧化)。
(有弱碱性,易被氧化)。
请回答下列问题:
(1)化合物C中官能团的结构简式为____________,检验反应③进行程度的试剂有____________。
(2)合成路线中反应类型属于取代反应的有____________个
(3)反应①的化学方程式为____________,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为____________。
(4)反应⑤的化学方程式为____________。
(5)甲苯的链状且仅含碳碳三键的同分异构体有____________种,其中满足下列条件的同分异构体的结构简式为____________。
①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3
(6)化合物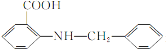 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
提示:①合成过程中无机试剂任选:②合成路线流程图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com