
科目: 来源: 题型:
【题目】I.一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:

(1)该反应的化学方程式是 。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g) + 2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.36mol/(Lmin)。
xC(g) + 2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.36mol/(Lmin)。
求:(1)平衡时D的浓度= mol/L。
(2)B的平均反应速率υ(B)= mol/( L.min)。
(3)x= 。
(4)开始时容器中的压强与平衡时的压强之比为 。(化为最简整数比)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。用乙烷制备氯乙烷的化学方程式是:____________,反应类型为__________。用乙烯制备氯乙烷的化学方程式是: 。
(2)乙炔(HC≡CH)也是一种不饱和烃,与乙烯具有相似的化学性质,写出乙炔与足量溴水反应的化学方程式: 。
(3)已知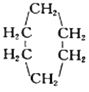 可表示为
可表示为![]() ,下图是某高聚物的合成路线,试完成下列试题:
,下图是某高聚物的合成路线,试完成下列试题:
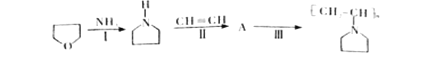
①Ⅱ反应类型 。
②Ⅲ反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式: 。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为 。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量 (填字母)可以看到白色沉淀生成。
A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某天然油脂的分子式为C57H106O6。1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1。下列说法错误的是
A.X的分子式为C18H32O2
B.脂肪酸Y能发生取代反应
C.Y的结构简式可能为CH3CH=CH(CH2)14COOH
D.Y的结构简式为CH3(CH2)16COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。

(1)写出BA3的电子式___________;
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个取向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________;
,该同学所画的电子排布图违背了___________;
(4)G位于_____族______区,该元素的核外电子排布式为___________;
(5)DE3中心原子的杂化方式为________,用价层电子对互斥理论推测其空间构型为___________;
(6)检验F元素的方法是___________,请用原子结构的知识解释产生此现象的原因___________;
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________。
(2)前5min内用B表示的化学反应速率v(B)为___________。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式_________________。
(2)298 K时,在2L恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。

①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示。
下列说法正确的是( )
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图3所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚酯纤维是目前产量第一的合成纤维.它可通过如下路线合成:

(1)若W的核磁共振氢谱显示有两个峰,且峰面积之比是2 :3。
① W物质的结构简式为 。
② 生成W的反应类型为 。
(2)若G的摩尔质量是116 g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。
① 下列叙述中不正确的有 。
a.A的同系物中可能存在顺反异构现象
b.反应I需要在NaOH的乙醇溶液中完成
c.W与A均能使酸性KMnO4溶液褪色
d.在B中滴加AgNO3溶液会马上产生淡黄色沉淀
② 完成下列化学方程式
C→D: 。
D→E: 。
C+ F→G: 。
③ J有多种同分异构体,满足以下条件J的同分异构体的个数是 ;
A.遇FeCl3溶液呈紫色 B.能发生银镜反应
C.1 mol J能与最多3 mol NaOH反应;
④ 生产中为提高产品质量,将粗品J溶于热水、趁热过滤、 ,获得J的精品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com