
科目: 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:
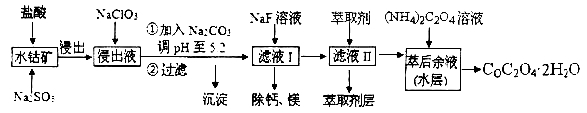
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为 ______________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____________________________________。
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液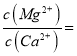 ______。
______。
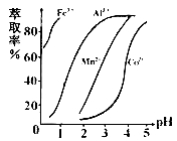
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
a.1 b.2 c.3 d.4
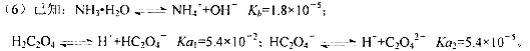
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol—1
SO3(g)+NO(g)的ΔH= kJ·mol—1
(2)利用反应6NO2+ 8NH3 ![]() 7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。
7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。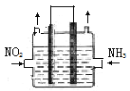
(3)一定条件下,将NO2与SO2以体积比1︰2置于恒容密闭容器中发生下述反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的物质的量比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
(4)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
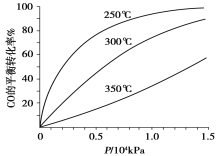
(5)不同温度CO的平衡转化率与压强的关系如上图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料[含SiO2和Cu2(OH)2CO3]回收铜的工艺设计。回答下列问题:

(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式:______________________。
(2)固体X的成分是__________,反应Ⅰ的化学反应方程式____________________________。
(3)试剂Y为__________,加快反应Ⅱ速率的措施有__________________(任写一条)。
(4)反应Ⅲ的离子方程式为________________________________________。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.

请回答下列问题:
(1)组成B单质的元素在周期表第 周期第 族 .化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有 个.
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 克固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物M(![]() )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题:
(1)M的分子式为 。
(2)M与H2按物质的量比1:1反应的产物,可能具有的性质是 (填序号)
A.易燃 B.难溶于水 C.可发生加成反应
(3)某耐热型树脂R可由M和丙烯腈(CH2=CHCN)共聚而成。假定按1:1比例反应,试写出R的结构简式: 。
(4)以M为原料合成产品N(![]() )的流程如下(条件略)
)的流程如下(条件略)

则A的结构简式为 ,反应②的发生条件通常是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙、丙三种物质:

(1)乙中含有的官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
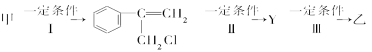
其中反应Ⅰ的反应类型是______________,反应Ⅱ的条件是__________________,反应Ⅲ的化学方程式为_________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下
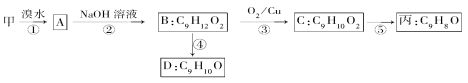
①下列物质不能与B反应的是________(填字母)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
②丙的结构简式为______________。
③D符合下列条件的所有同分异构体________种,任写其中一种能同时满足下列条件的同分异构体结构简式:___________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:
![]()
(1)已知:

计算上述反应的△H=________ kJ·mol-1。
(2)维持体系温度和总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=___________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)如右图所示:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 。
②控制反应温度为600℃的理由是 。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com