
科目: 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为______,B为______,C为______。
(2)E的电子式为 。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:__ ___。
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
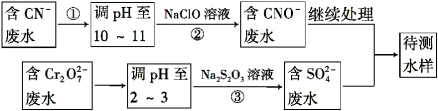
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
科目: 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_______。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:

M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:


请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是____________________
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是____________(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO、CO2的应用具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ;
CH3OH(g)+H2O(g) ;
测得CH3OH的物质的量随时间的变化图:

①由图判断该反应ΔH 0,曲线I、II对应的平衡常数KI KII(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
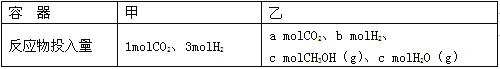
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(3)将燃煤废气中的CO转化为二甲醚的反应原理为:
2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白:
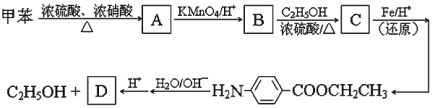
⑴ 写出化合物 B 的结构简式: 。
⑵ 由 B 到 C 的反应类型是 。
⑶ 任意写出两种同时符合下列要求的化合物 C 的同分异构体的结构简式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基;
② 分子中含有 -COO- 结构的基团。
![]()
![]()
![]()
⑷ E、F、G 中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是 (在 E、F、G 中选择,填字母)。
⑸ 一定条件下,化合物 D 发生聚合反应的化学方程式是: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的( )
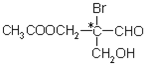
A. 与乙酸发生酯化反应
B. 与NaOH水溶液反应
C. 与银氨溶液作用只发生银镜反应
D. 催化剂作用下与H2反应
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铅,又名石灰浆,可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是__________________________。
反应过程中可观察到淡黄色沉淀,则①对应的离子方程式为_____________________。
(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是_____(请用平衡移动原理解释)
(3)④中对应反应的平衡常数表达式________。
(4)上述流程中可循环利用的物质有_________________。
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为_________________.。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,
实验结果记录如下:

I.由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_____。
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+D2Pb(s)+2H+,则脱铅时最合适的pH约为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语中正确的是
A.NH4HCO3溶液中加入足量的NaOH浓溶液:NH4+ + OH- = NH3↑ + H2O
B.向FeBr2溶液中滴加少量氯水:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
C.用电子式表示HCl的形成过程:![]()
D.硫磺在空气中燃烧:2S + 3O2 ![]() 2SO3
2SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】碳单质及其化合物有广泛的应用。
(1)碳的同素异性体金刚石、石墨和C60晶体中,能溶于有机溶剂的是___,原因是_______。
(2)CH3COCH=CHCH3分子中,C原子所采取的杂化类型有____________。
(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用虚线标出了石墨的一个六方晶胞。该晶胞中含有的碳原子数为_____个。
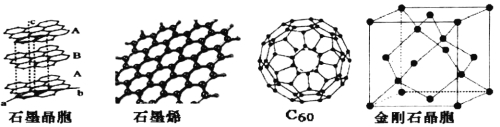
(4)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图所示。1mol石墨烯中含有的六元环个数为______,下列有关石墨烯说法正确的是________
a.晶体中碳原子间全部是碳碳单键
b.石墨烯中所有碳原子可以处于同一个平面
c.从石墨中剥离得到石墨烯需克服分子间作用力
(5)石墨烯可转化为C60,C60的结构如图所示,该分子是由五边形和六边形构成的球体,其中五边形有12个,六边形有________个。
(6)金刚石晶胞如图所示,则金刚石晶胞中原子的配位数为_____,原子空间利用率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com