
科目: 来源: 题型:
【题目】化合物A、B、C均由X、Y、Z三种元素中的两种或三种组成,分子中所含X、Y元素的质量分数及化合物的部分性质列于下表,根据表中有关信息回答下列问题:

(1)由A的密度和沸点可知,A的分子式是_________________。
(2)B是一种烃,则B的分子式是_________________。
(3)根据上述推导结果,计算化合物C的分子式。(书写详细解答过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
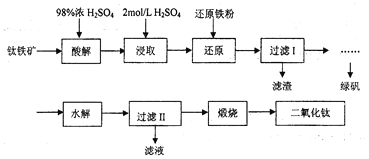
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
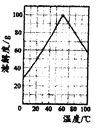
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
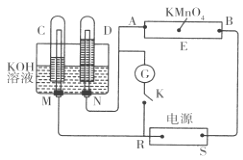
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素名称分别是:A___________,B___________,C___________,D___________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_______________。(用化学式表示,下同)
(3)A与B形成的三原子分子的电子式是___________,B与D形成的原子个数比为l∶l的化合物中含有的化学键类型有___________。
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5H2O和Fe3O4.
(1)基态铁原子的外围电子层排布为______________,该元素位于元素周期表中的第______________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中______________更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为______________。
(3) 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )

A.分子中5个R-Cl键键能不都相同
B.键角(Cl-R-Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
(4)因为氯化铝易升华,其双聚物Al2Cl6结构如图1所示.1mol该分子中含______________个配位键,该分子______________(填“是”或“否”)平面型分子.
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308. 8 K,主要原因是______________。
(6)二硫化碳属于_____________ (填“极性”或“非极性”)分子。
查看答案和解析>>
科目: 来源: 题型:
【题目】用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:

(1)在配制混合酸时应将___________加入到___________中去;
(2)被水浴加热的试管口处都要带一长导管,其作用___________。
(3)该反应的化学方程式是___________;反应类型:___________。
(4)此装置存在几处错误,请修改(可不必填满).①______;②______;
③________。
(5)请从下列操作:①蒸馏;②水洗;③用干燥剂干燥;
④用10%NaOH溶液洗;⑤水洗,选择合适操作,进行分离混酸后的粗产品精制:分液________分液________分液________过滤________。(用序号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
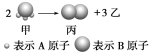
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液: 。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸(俗名草酸)广泛存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,但其钙盐难溶于水。其晶体(H2C2 O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
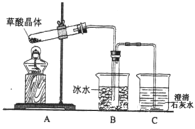
(1)某实验小组同学想通过实验探究草酸晶体的分解产物,设计了右图的装置,其中装置B的主要作用是_____________________。通过观察装置C中的__________________________现象,可以确定草酸晶体分解的产物中有_________________________________。
(2)另一组同学认为草酸晶体分解的产物中不可能只有CO2,从氧化还原反应知识的原理推测可能含有 CO,为了进验证此猜想,该组同学选用了实验中的装置 A、B 和下图所示的部分装置(可以重复选用)进行实验。
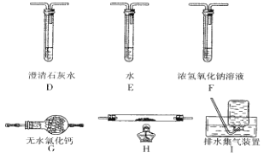
①该组同学的实验装置中,依次连接的合理顺序为 A、B、_______________。装置H反应管中盛有的物质是__________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
(3)设计实验证明草酸的酸性比碳酸的强___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各组粒子互为同位素的是 (填编号,下同)。互为同素异形体的是 ,互为同分异构体的是 互为同系物的是 。
①16O2和18O3
②质子数相同而中子数不同的两种粒子
③11H、D、T
④3015R和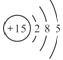 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖
⑥
⑦CH3CH2CH2CH2CH2CH3和(CH3)2CHCH(CH3)2
⑧(CH3)2CHCH(CH3)2和C(CH3)4
(2)生活中的一些问题常涉及化学知识,下列叙述正确的是(填序号) 。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
⑦为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
(3)在实验室生成乙酸乙酯的可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:

(1)操作Ⅱ中,通入硫化氢至饱和的目的是______________;在溶液中用硫酸酸化至pH=2的目的是______________。
(2)滤渣Ⅱ的主要成分是______________。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______________(填仪器名称).
②判断此滴定实验达到终点的方法是______________。
③计算上述样品中FeSO47H2O的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com