
科目: 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
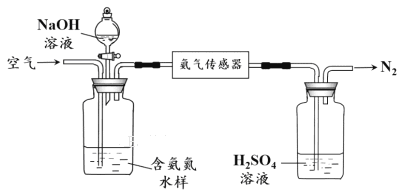
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
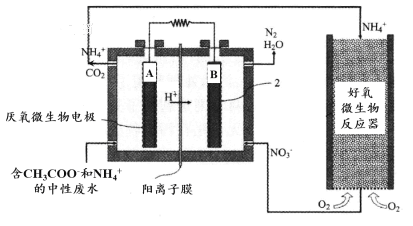
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
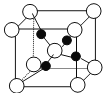
①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨ 种元素,填写下列空白:

(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子式是: 。
(3) 最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程 ,该化合物属于 (填“共价”或“离子”)化合物。
(5)元素①的氢化物的电子式为 ,该化合物是由 (填“极性”或“非极性”)键形成的。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用惰性电极电解K2MnO4水溶液的方法来生产KMnO4,请写出阳极的电极反应式 ,电解总反应的化学方程式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 制得硫酸锰晶体。(MnSO4H2O,相对分子质量为169)
a.过滤 b.蒸发浓缩 c.冷却结晶 d.灼烧
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环:
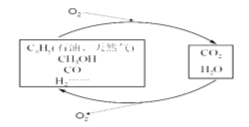
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。下图是生成1molCH3OH时的能量变化示意图。
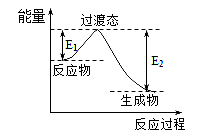
已知破坏1mol不同共价键的能量(kJ)分别是:
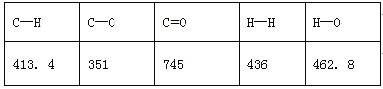
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
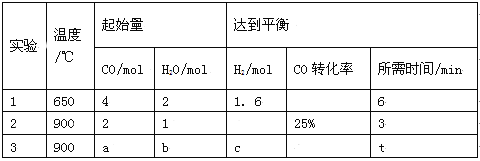
① 该反应的ΔH__________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为25%,则a/b=______。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” 或“>” 或“=”)。
(3)捕捉CO2可以利用Na2CO3溶液。先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是___________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶。Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
(1)铬原子核外有______个未成对电子。1mol[Cr(H2O)6]3+中含有δ键的数目是______。
(2)CH3COOH中C原子轨道杂化类型为_________。
(3)CH3CH2OH与H2O可以任意比互溶,是因为_________。
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C_____O(填“>”或“<”)
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该晶体的化学式为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
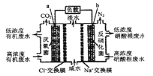
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com