
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
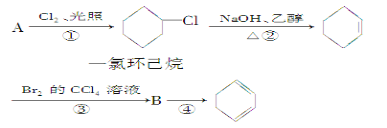
(1)A的结构简式是________________,名称是__________________。
(2)①的反应类型是____________,②的反应类型是________________
(3)反应①和②的化学方程式是____________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是( )
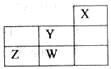
A. W的最高价氧化物对应的水化物是强酸
B. W的非金属性比Z的弱
C. Y的原子半径在同周期主族元素中最大
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目: 来源: 题型:
【题目】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:

已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(5)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
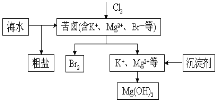
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________。
② 水_______(选填“能"或“不能”)作为装置II中的试剂,理由是_________________。
③ 装置III中反应完全后,接下来的操作是_________________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______(选填“增多”、“减少"或“不变”),原因可能是______________(用化学方程式解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol (C2H5O)3P=O分子中含有的σ键与π键的数目比为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:

解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为a pm,则碳化硅的密度为__________g·cm3。

查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:

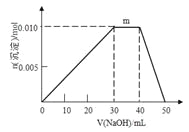
(1)f在元素周期表的位置是____________________________。
(2)比较d、e常见离子的半径大小______>______(用化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性强弱___________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式______________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图所示。
① 写出m段反应的离子方程式_______________________________。
② 若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:

A.①、②反应依次为加成反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,乳酸[CH3CH(OH)COOH]成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。请完成下列有关问题:
(1)写出乳酸分子中所有官能团的名称_____________。
(2)在一定条件下,下列物质不能与乳酸发生反应的是________。
A.溴水 B.NaOH溶液 C.Cu(OH)2悬浊液 D.C2H5OH
(3)如果以丙烯(CH2=CH—CH3)为主要原料(其他无机原料任选)合成乳酸,其合成过程的流程图如下:
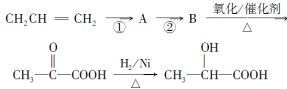
则①的反应类型是________;反应②的化学方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图填空。
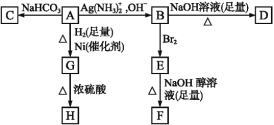
已知H是环状化合物C4H6O2,F的碳原子都在一条直线上。
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时发生两种反应,其反应类型分别是 。
(3)D的结构简式是 。
(4)1 mol A与2 mol H2反应生成1 mol G,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com