
科目: 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
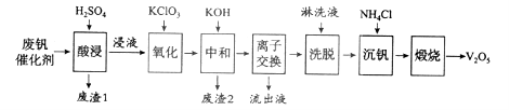
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH)
B.12C60和石墨
C.乙醇和乙二醇
D.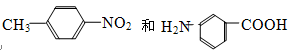
E、35Cl和37Cl
①互为同分异构体的是 ;
②互为同系物的是 ;
③不是同系物,不是同分异构体,也不是同素异形体,但可看成是同一类物质的是
查看答案和解析>>
科目: 来源: 题型:
【题目】本题有三小题。
(1)已知N2,CO,H2O,NH3,CO2均为高中化学常见的分子,根据要求回答有关问题:
①根据等电子体原理,写出CO分子的结构式___________。
②试比较两分子中的键角大小:H2O___________NH3,(填“>”、“=”或“<” )
③基态N原子核外电子有 种不同的运动状态, B、C、N、O的第一电离能由大到小的顺序为 .
(2)科学家合成了Si60、N60, Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则28 g Si60分子中π键的数目为 。
(3)①立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。
②在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。

(4) “嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为 .
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 .
③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
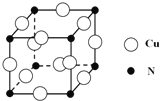
查看答案和解析>>
科目: 来源: 题型:
【题目】第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价电子排布图为______________。
(2)汽车安全气囊的产生药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中阴离子的立体构型______________。
(3)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O,产物中的H[AuCl4]是配合物,它的配位体是______________,发生电离的方程式为______________
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明是节能减排的有效举措,已知砷化镓的晶胞结构如图,晶胞棱长为apm。
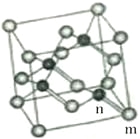
①砷化镓的化学式______________,镓原子的配位数为______________。
②砷化镓的晶胞中m位置Ga原子与n位置As原子之间的距离为________pm (用含“a”的表达式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和元素的性质。下是元素周期表的一部分。
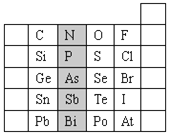
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应:
①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
(1)属于复分解反应的放热反应的是____________________________。(用序号填空)
(2)属于吸热反应的是_____________________________________________。(用序号填空)
(3)能设计成原电池的反应是_______________________________________。(用序号填空)
(4)能设计成燃料电池的反应是_____________________________________。(用序号填空)
(5) 写出③发生反应的化学方程式___________________________________。
写出④发生反应的离子方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
① 金刚石与石墨; ② 氧气(O2)与臭氧(O3);
③ 16O、17O和18O; ④ CH4和CH3CH2CH3;
⑤ 乙烯和乙烷;
⑥![]() 和
和![]() ; ⑦
; ⑦![]() 和
和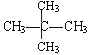 ;
;
(1)同位素 ,(2)同素异形体 ,
(3)同系物 ,(4)同分异构体 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
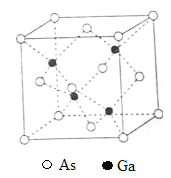
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是
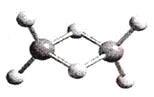
A. Al2H6在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. Al2H6中含有离子键和极性共价键
D. Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com