
科目: 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
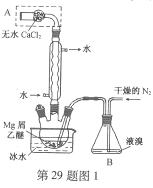

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A. 反应①、②中电子转移数目相等
B. 反应①中氧化剂是氧气和水
C. 与铜质水龙头连接处的钢质水管不易发生腐蚀
D. 钢铁在潮湿的空气中不能发生电化学腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
(1)用铜作阳极,钦片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图所示。

将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为___________。图中③④两步反应的总反应离子方程式为________________。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1;按![]() 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。

①图中压强pl、p2、p3由大到小的顺序是_________。
②a _________(填“>”或“<”) 0。
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡,该温度下反应的平衡常数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目: 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸480mL。
(1)选用的主要玻璃仪器有:
①_______,②_______,③_______,④______,⑤________。
(2)简要回答下列问题:所需浓硫酸的体积为_______mL(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的? (用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是: 。
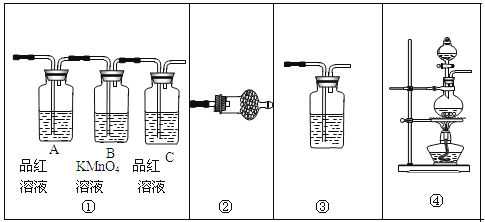
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______,B瓶的作用是______,C瓶的作用是______。
(4)装置②中所加的试剂名称是______,它可以验证的气体是______,简述确定装置②在整套装置中的位置的理由是___ ___。
(5)装置③中所盛溶液的名称是______,它可以用来验证的气体是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是①Cl2 ②NO2 ③H2S ④SO2 ⑤溴蒸气 ⑥HCl中的 ( )
A.①④⑤ B.①②⑤ C.①②⑥ D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
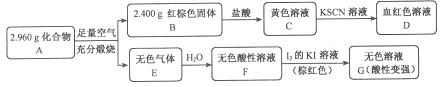
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com