
科目: 来源: 题型:
【题目】下列有关煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.煤的气化就是将煤在高温条件由固态转化为气态,是物理变化过程
C.天然气是一种清洁的化石燃料
D.煤就是碳,属于单质
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
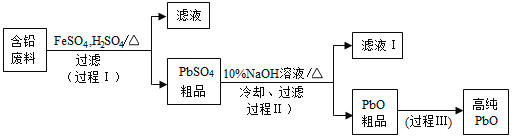
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
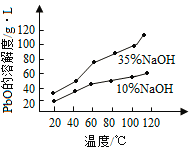
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)E元素在周期表中的位置: 。
(2)A、D、E元素简单离子半径由大到小的顺序为 > > (填微粒符号)。
(3)F与D同主族且相邻,二者气态氢化物稳定性的大小关系为 > (填微粒符号)。
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出阳离子的电子式: ,该阳离子中存在的化学键有 。
(5)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
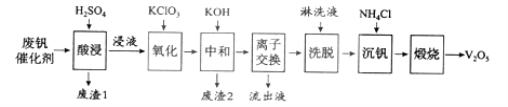
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl22H2O)。工业流程如下:
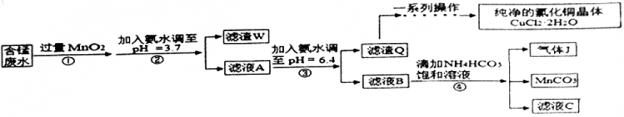
已知:几种金属离子沉淀的pH如表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为
(2)过程②中,所得滤渣W的成分是 。
(3)过程③中,调pH=6.4目的是 。
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是 。
(5)将滤渣Q溶解在过量的盐酸中,经过 ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl22H2O)。
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。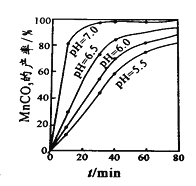
据图中信息,你选择的最佳pH是 ;理由是 。
(7)从滤液C可得到的副产品是 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是 (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S
d.生成2.24 L(标况下) SO2,转移电子的物质的量是0.6mol
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-→ 2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是 >_________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是 mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在容积为3 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
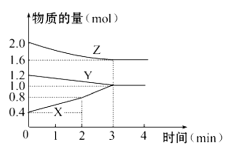
(1)该反应的化学方程式为____________ _______。
(2)反应开始至2 min末,X的反应速率为_____ ____。
(3)该反应是由__________(填序号)开始的。
①正反应 ②逆反应 ③正、逆反应同时
(4)若增加Y的用量,化学反应速率不变化,则Y为__ ___态。
查看答案和解析>>
科目: 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
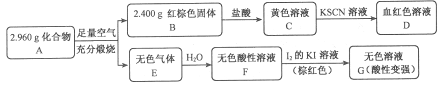
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯水与SO2气体都具有漂白性,若将等体积的氯气和SO2通入到水中,得到的溶液是否具有漂白性?_______________(填“是”或“否”). 用化学方程式表示其中的原因 。
(2)氨气在实验室中可快速制得,请写出相关的化学方程式:
。
验满的方法是: 。
(3)写出铜在浓硝酸中反应的离子方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com