
科目: 来源: 题型:
【题目】下列陈述正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Q、R、Z、T、U分别代表原子序数依次增大的元素。X是原子半径最小的元素,短周期中Q原子含有的未成对电子数最多,R和T属同族,T的原子序数是R的两倍,Z的单质的同周期中熔点最高;U5+的核外电子排布和氩元素相同。
(1)U基态原子的原子结构示意图为 。
(2)在(QX4)2TR4的晶体中存在的化学键类型有 。
a.离子键 b.共价键 c.配位键 d.金属键
(3)Q、R、T所对应元素的第一电离能由大到小的顺序是 (填元素符号)。
(4)TR2是 分子(填“极性”或“非极性”)。ZR2晶体结构如图I,6g ZR2中所含Z—R键的数目为 。
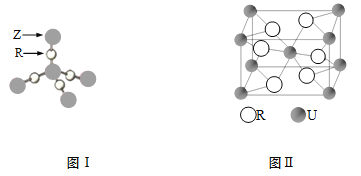
(5)U和R形成的化合物的晶胞结构如图II所示,该化合物的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
(1)在下列装置中,第一次浸出必须用____________,第二次浸出应选用____________。(填标号)

(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成___________。滤渣2的主要成分是____________________。
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________________。
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气在纯氧中燃烧(如图所示),生成化学性质稳定的气体X和水。下列说法正确的是
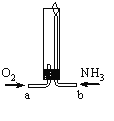
A.气体X的分子式为NO
B.N2、N4为元素N的两种同素异形体
C.该反应条件下,氨气的还原性小于水
D.两种气体通入的先后顺序是NH3、O2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
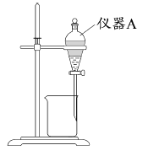
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质按纯净物、混合物、强弱电解质和非电解质顺序排列的是
A.单甘油酯、混甘油酯、苛性钾、H2S、三氧化硫
B.胆矾、漂白粉、硫酸钠、次氯酸、氯气
C.明矾、水煤气、盐酸、醋酸、铜
D.冰醋酸、福尔马林、硫酸钡、H2S、乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. 液化石油气和天然气的主要成分都是甲烷
C. 石油裂解、裂化和重整都是有机高分子生成小分子的过程
D. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
B.油脂都不能使溴的四氯化碳溶液褪色
C.石油分馏、煤的干馏均为物理变化
D.淀粉、蛋白质和天然橡胶均是天然高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T元素的离子结构示意图为__________。
(2)元素的非金属性(原子得电子的能力):Q ________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为_________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________其反应物的电子式为 。离子半径T3+__________R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com