
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的单质和它的一种氧化物是工业生产上常用的还原剂。B的最外层电子数是次外层的3倍;0.1molC的单质能从酸溶液中置换出2.24L标准状况下的氢气;又知B、C、D所形成的简单离子的电子层结构相同,B和E是同主族的元素。请回答下列问题:
(1)请依次写出A、C、E三种元素的元素符号: 、 、 。
(2)请写出A的最高价氧化物的电子式 ;E的单质在空气中燃烧所生成物质的化学式 。
(3)A元素可以形成多种同素异形体,其中硬度最大,不导电的是 (填物质名称);熔点高,可以导电的是 (填物质名称)。
(4)请写出C的单质与A、B形成的化合物反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于Zn(s) + H2SO4(aq) ═ ZnSO4(aq) + H2(g) △H=?的化学反应,下列叙述不正确的是 ( )

A、反应过程中能量关系如图所示,则该反应为放热反应
B、化学反应的反应热与反应方程式的计量数有关
C、若将该反应设计成原电池,锌为负极
D、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组的同学利用如图所示装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。

请回答:
(1)根据上述实验装置,为制备干燥NH3,可选用的发生、净化装置为 接 。其中发生装置中可以选用的药品为 (填选项字母)
a.碱石灰和浓氨水 b.浓H2SO4和浓氨水 c.碱石灰和氯化铵 d.生石灰和氯化铵
(2)根据上述实验装置,用MnO2和浓盐酸制备纯净、干燥的Cl2,可选用的发生、净化装置为 接E、接E,第一个E装置的药品是 。
(3)利用装置F可探究Cl2与 NH3 的反应。
已知Cl2与 NH3可发生反应:3Cl2+2NH3=N2+6HCl
①实验时打开开关1、3,关闭2,先向烧瓶中通入 (气体名称),然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。
②实验一段时间后烧瓶内出现的现象为: 。
③装置F中烧杯内发生反应的离子方程式为 。
④请设计一个实验方案(操作过程、实验现象)鉴定烧瓶内最终产物的阳离子,其方案为 。
(4)一定条件下,Cl2 与CH4在装置F中发生反应,其有机产物有 。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示0。
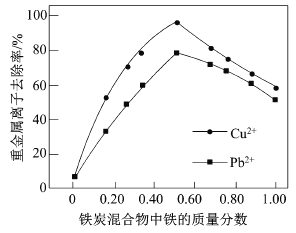
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
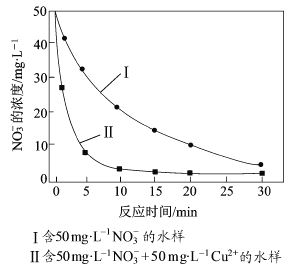
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。
根据①~元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)

(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: 。
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H 2 (g)=MgH 2 (s) △H 1 =-74.5kJ·mol -1
Mg 2 Ni(s) + 2H 2 (g)=Mg 2 NiH 4 (s) △H 2 =-64.4kJ·mol -1
Mg 2 Ni(s)+2MgH 2 (s) = 2Mg(s)+Mg 2 NiH 4 (s) △H 3
则△H 3 = kJ·mol -1 。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl 2 ·6H 2 O转化为MgCl 2 ·NH 4 Cl·nNH 3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4) 2 在110~200°C的反应为:Mg(AlH4) 2 =MgH 2 +2Al+3H 2 ↑每生成27gAl转移电子的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:
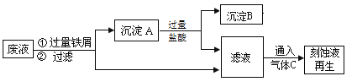
(1)沉淀A中含有的单质是 。
(2)通入的气体C的化学式是 。
(3)滤液与气体C反应生成刻蚀液的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素, 它们的原子序数依次增大。 已知A和B原子具有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍, C是该周期中原子半径最大的元素, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。 试根据以上叙述回答:
(1)元素名称: A C __________ E
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;写出 C2B2与AB2反应的化学方程式 ;
(3)画出D的原子结构示意图 ,用电子式表示化合物 C2D 的形成过程 ;
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
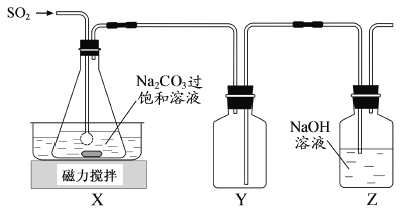
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3=Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1— — —2—3 —6—7 — — 。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 。
(3)A装置中发生反应的离子方程式为 。
(4)B装置中发生反应的化学方程式为 ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 。
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com